みなさんは水道水やどろ水などをキレイにしようと思ったとき,どのような方法を使いますか?
ほとんどの人はろ過をすることがアイデアの1つとして思いつくのではないでしょうか。
もちろんそれは正しいです。ろ過をすることによって,液体の中に混ざっている大きなつぶを取り除くことができます。
そして,うまくろ過をすることができれば,とう明な水を手に入れることができるでしょう。
さて,見た目はキレイになりました。しかし本当にそれはキレイに純すいな水だけなのでしょうか。
実はそうではないのです。
水の中にある物体の中には,目に見えないものもあります。ろ過では,目に見えないもののほとんどを取り除くことができません。
例えば,みなさんが何気なく飲んでいる水道水の中には,殺菌(さっきん)のために「塩素」がふくまれています。目には見えないですが,確かにふくまれています。さて,こういった物質を取り除くにはどうしたらいいでしょう。
ほとんど何もふくまれていないキレイな水の1つに,「蒸留水」と呼ばれるものがあります。
これはその文字通り,「蒸留」という方法を使ってキレイにした水のことです。
それでは「蒸留」とは一体何なのでしょうか。
今回は「蒸留とは何か」,「蒸留はどういう原理なのか」,「蒸留はどのように使えるのか」といったことをしょうかいしていきましょう。
Contents
「蒸留」とは
まずは上で出てきた「蒸留」というものについて,細かい説明は後回しにして簡単に説明しましょう。
上では水の例をしょうかいしましたが,物質をキレイにするというのは,物質について調べる人にとってはとても重要なことです。
ある物質の性質を知るための様々な実験をするときに,目的の物質以外のものが入っていたら,そのジャマな物質によって何も分からなくなったり,本来とはちがう結果が出てきてしまうのがほとんどです。
そのためには「物質をキレイにする」,つまり「目的の物質からジャマな物質を取り除く」,もっと言えば,「欲しい物質」と「ジャマな物質」を「分ける」技術がとても大事になってくるのです。
みなさんは,大量のリンゴの中に混ざったレモンを分けてくださいと言われたら,きっと簡単にそれができるでしょう。このとき,例えば「赤いもの」と「黄色いもの」といったように,リンゴとレモンのちがいに注目するはずです。
欲しい物質からジャマな物質を分けるときも考え方は同じです。この2つ(またはそれ以上)の物質同士の間にある違いに注目します。
ここでは,物質の「沸点(ふってん)」のちがいに注目します。
例えば水の沸点は100℃ですが,アルコール(エタノール)の沸点は78℃といったように,沸騰(ふっとう)する温度というのは物質ごとに違います。
「蒸留」とは,このような「沸点のちがいを利用して,物質を分ける」方法です。まずはこのポイントをしっかり頭に入れてください。
このことをふまえたうえで,次は蒸留の具体的な方法について確認していきます。
蒸留の方法
蒸留とは何かを簡単に確認したところで,実際の方法について見ていきましょう。ここでは「どんな装置を使うのか」,「直観的に何が起こるのか」をつかんでください。
実験で行う蒸留では,下のような装置を使います。
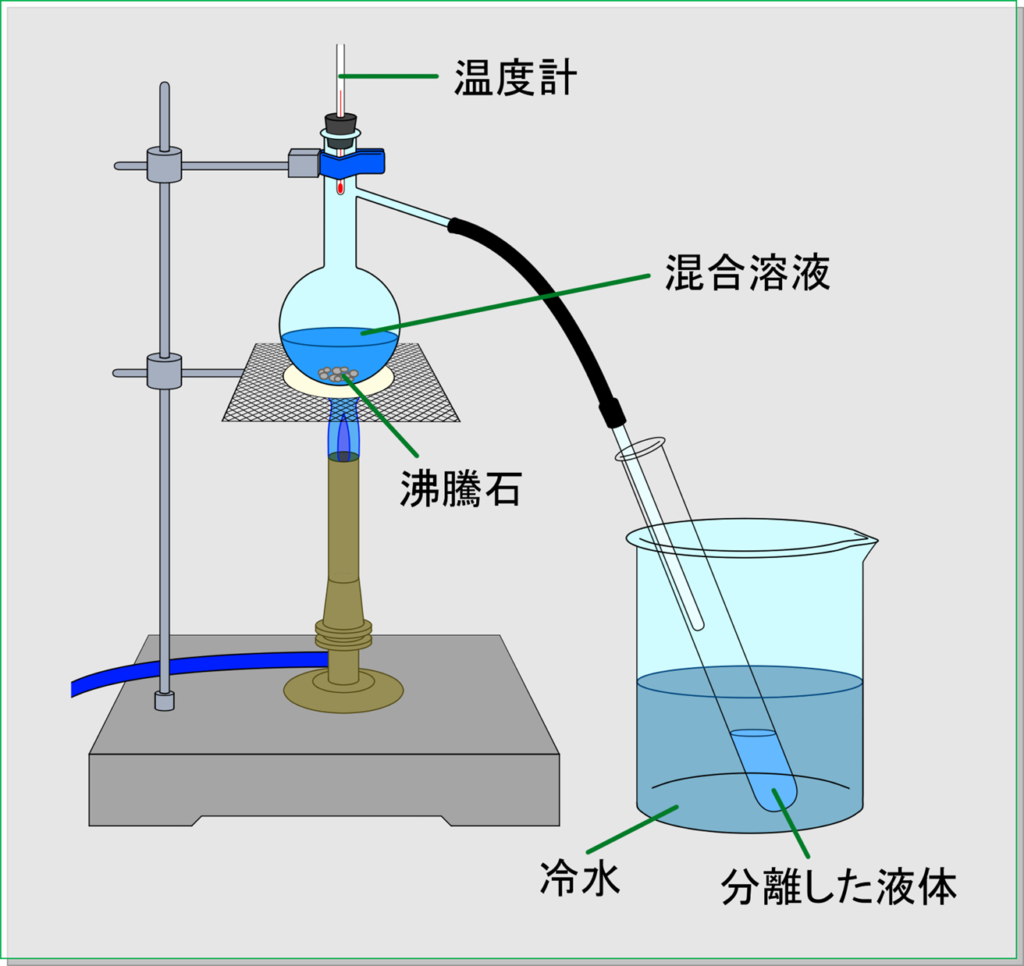
図の左上にあるような,本体の上部分で管が分かれているようなフラスコのことを,「枝付きフラスコ」といいます。この枝付きフラスコの中に,欲しい物質が混ざっている液体を入れます。
そして温度計が付いているフタをし,横に出ている枝の部分にゴム管とガラス管をつなぎます。そして冷たい水にひたした試験管の中にガラス管を入れます。そしてガスバーナーでフラスコに入った液体を熱します。そうすると次第に試験管の中に液体がたまっていきます。
これが,私たちが今欲しい物質であり,キレイな状態として出てきます。ジャマな物質は,フラスコのままに残ります。
例えば,水とエタノールが混ざった液体でこの実験を行うと,試験管の中には,キレイな(水が混ざっていない)エタノールが出てきます。
つまり,このような装置で,「フラスコ部分を加熱」すると,欲しい物質が,「他のジャマな物質から分かれて」,「試験管の中へ出てくる」のです。
さて,何が起こるかを確認したら,今度は「どうして」そうなるのかを確認しましょう。
蒸留の原理
ここからは,上でしょうかいしたような蒸留の方法で物質がキレイになる理由について学んでいきましょう。ここでも水とエタノールの場合で説明していきます。
「蒸留とは」の部分でも書いたように,水とエタノールでは沸点がちがいます。改めて書くと,水の沸点は100℃ですが,エタノールの沸点は78℃となっています。
そこで,水とエタノールが混ざった液体を熱すると,水よりも先に,液体にふくまれているエタノールが沸騰し,蒸発して気体になります。
気体になったエタノールは,枝付きフラスコの枝の部分から,ゴム管,ガラス管を通って,試験管の方へと流れていきます。すると試験管は冷たい水でひたされた状態のため,気体のエタノールはここで冷やされます。冷やされたエタノールの気体は再び液体へと状態変化をします。そのため,試験管の中に,液体として少しずつたまっていくのです。
フラスコ内の液体の温度がエタノールの沸点より高く,水の沸点よりも低い状態を保つことで,水が沸騰して気体になり,気体のエタノールに混ざるのをかなり防ぐことができます。
まとめると,物質が混ざった液体を熱することで,「沸点が低い物質だけ」を,「いったん蒸発させて」,ジャマな物質から分かれたところで,別の場所で「冷やす」ことでキレイな状態の液体として手に入れることができるというわけです。
「蒸留」によって,「沸点が低い物質」を分けられるということを理解していただけたでしょうか。
蒸留によってキレイな物質を手に入れる方法が分かったところで,蒸留の実験を安全に行い,キレイな物質をしっかり手に入れるうえでの注意点についての知識も身に付けていきましょう。
蒸留実験の注意点
実験方法だけが分かっても,様々なことに注意しなければ,大きな事故やけがにつながります。ここでは安全に実験を行い,また同時によりキレイに物質を分けるための注意点について説明していきます。
ここでしょうかいするポイントは,次の5つです。
- フラスコ内に液体を入れすぎない
- フラスコの中に沸騰石を入れる
- 温度計の下の液だまりの部分が枝の部分にくるようにする
- 蒸留と初めと終わりに出てくる液体はキレイではない可能性がある
- ガラス管の先が液体の中に入らないようにする
それぞれ細かく見ていきましょう。
① フラスコ内に液体を入れすぎない
たくさん蒸留して一気にキレイな状態の物質を手に入れようとして,フラスコ内に元の液体をたくさん入れすぎないようにしましょう。
液体が多すぎると,沸騰したときに,液体がとびはねて枝の中に入り,試験管へ流れ出ていってしまう可能性があります。
これでは,せっかく取り出した物質の中に,キレイではない状態の液体が混ざってしまい,やり直しになってしまいます。
フラスコの中に入れる液体は,多くても丸い部分の半分以下にしておきましょう。
② フラスコの中に沸騰石を入れる
このような沸騰をともなう実験においては,沸騰石を入れましょう。
その目的は,とつぜんの大きな沸騰である「突沸(とっぷつ)」を防ぐためです。
突沸をすると,①のように液体が勢いよくとびはねる可能性があるのもそうですが,最悪フラスコがわれてしまい,熱湯によるやけどやガラスによるけがの危険性があります。
沸騰石を入れることで,安全な実験ができるようにしましょう。
③ 温度計の下の液だまりの部分が枝の部分にくるようにする
温度計を付ける場所についてですが,どこでもいいというわけではありません。
そもそもこの温度計は液体に入ってないのに,どのような役割をもっているのでしょうか。
この温度計の役割は,フラスコの枝の部分に入っていく気体の温度を測る役割をもっています。
キレイな物質というのは,決まった温度で沸騰するという性質があります。そのため,フラスコの液体から分けたい物質の沸点を知ってさえいれば,今フラスコの枝から試験管へ流れていっている気体が,本当に自分の欲しい物質なのかを確認することができるのです。
もしもここの温度が大きく変わってしまった場合は,気体の中に別の物質が混ざっている可能性が高く,実験を一度止めなければならないでしょう。そのため,蒸留を行うときは,温度計を付けることで,欲しい物質がキレイな状態で分けられているかを,常に確認しながら実験を行うようにしてください。
④ 蒸留と初めと終わりに出てくる液体はキレイではない可能性がある
これはもともとの液体にふくまれている物質の種類が多かったり,沸点が近い物質同士が含まれているときによく起こります。
蒸留の始めや終わりでは,欲しい物質よりも沸点が高い物質や沸点が低い物質の気体が混ざっている可能性があります。
また蒸留の始めでは,実験器具の中にあった汚れが一緒に流れてきてしまうこともあるでしょう。
そのため,液体がある程度出てくるまで待ち,そのあと試験管を変えて改めてキレイな状態の物質を回収するようにすると,よりキレイな状態で目的の物質を回収することができます。
試験管での回収を細かく何回かに分けて,蒸留の終わりの方に出てきた分だけ捨ててしまい,残りを合わせる方法で実験を行う工夫をするのもよいでしょう。
⑤ ガラス管の先が液体の中に入らないようにする
試験管に入れているガラス管,つまり蒸留してキレイになった成分の気体または液体が出てくるところが,液体の中に入らないようにしましょう。
液体の中に入っていると,熱するのを止めたときに液体が逆流してしまう可能性があります。蒸留中も液面に常に注意しながら実験を進めるようにしましょう。
蒸留の利用
さて,ここまで蒸留について様々なことをしょうかいしてきました。それでは蒸留は私たちの身近なところではどのようにして利用されているのでしょうか。
実は石油から灯油やガソリンを取り出すために蒸留の技術が使われているのです。石油には灯油やガソリン以外にも様々な物質が含まれていますが,それらの沸点に合わせて温度を調整して,そのとき発生した気体を集めることでそれぞれの成分に分けることができます。
例えば,30℃以下で石油ガスを多く含む気体,30℃~180℃でガソリンを多く含む気体,170℃~250℃で灯油を多く含む気体,240℃~350℃で軽油を多く含む気体,350℃~で残渣油を多く含む気体をそれぞれ回収することができます。
1度分けただけではまだその温度範囲の上下にある他の成分が混ざっているかもしれないので,温度に区切っておおまかに分けた後に,もう一度蒸留を行うことでさらにキレイにすることができます。
このようにして,石油を蒸留して,温度ごとに違う成分の気体が出てくるため,それらを別々に回収することで様々な物質を取り出すとともに,生産しているのです。
他には,アルコール度数の高いお酒を造るときにも蒸留の技術が利用されています。
上で説明したように,蒸留では水とアルコールを分けることができるので,初めはアルコールのこさが水などによってうすくなっている液体だったとしても,蒸留をすることでアルコールだけを取り出し,よりこいアルコールを含むお酒を造ることができるのです。
うすくするだけなら,後から水を入れて調整すればいいのです。
もし将来お酒を飲むときは,自分の体のことやアルコールなどについての知識をしっかり身に付けてから,健康に気を付けて飲むように注意しましょうね。
入試実践演習
ここまでに学習したことを活かして,実際の入試問題に挑戦してみましょう。
問題


解答
- (1) (ア)
- (2) (エ)
- (3) ① 150 L ② 214L
- (4) (カ)
- (5) 60000
- (6) 不要になったペットボトルを繊維としてリサイクルして利用する
解説
(1)
問題文の下線部に書いてあるように,蒸留では目的の物質を「蒸発させて」,気体にさせた後に,冷やして液体に戻すことでキレイな状態で回収します。
ここで重要なのは,この記事で説明してきたように,「沸点が低い物質」だけを蒸発させて回収する点にあります。
つまり,水だけを回収するような蒸留で適切なものは,水がもともとの液体の中で「沸点の低い物質」である必要があります。
この条件を満足するのは,(ア)の食塩水しかありません。
問題の表1にあるように,水の沸点は100℃で,食塩の沸点は1465℃であるため,水だけが沸騰して気体となり,食塩はフラスコの中に残ります。
(イ)~(エ)では液体に含まれている物質のうち,水の方が沸点が大きくなってしまっているので,正しくありません。
ここで,例えばエタノール水溶液を蒸留して,キレイな水を手に入れようとしたときに,エタノールが蒸発させたのならば,フラスコ内に残った水はキレイなはずだからそれでいいではないかと思った人もいるのではないでしょうか。
少し細かいのですが,蒸留は基本的にフラスコ内から目的の物質が全てなくなるまでは行いません。
なぜかというと,上でも少ししょうかいしたように,限界まで熱してしまうと,他の物質の気体が混ざってしまいます。
例えば,エタノール水溶液を,エタノールがなくなるまで蒸留を行ってしまうと,最後の方にフラスコで発生する気体の中に,蒸発した水が混ざってしまいます。
そのため,できればエタノールが少し残った状態で止められるのが好ましいです(実際には目で判断できないので難しいですが)。
またフラスコ内に3つ以上の物質が含まれているときは,1回の蒸留でもフラスコ内に少なくとも2つ以上の物質が残った状態になります。
そのため,蒸留で取り出したい物質は,基本的に試験管に出てくる方です。
フラスコ内の物質はキレイな物質を得るという目的で回収することは基本的にはないと思っていただいて問題ありません。
(2)
物質が状態変化するとき,基本的に全体の質量(重さ)が変化することはありません。変わるのは,体積です。
固体→液体→気体となるにつれて,基本的には体積が大きくなっていきます(水は例外です)。そのため,(エ)が正しいということになります。
(3)
①
ビール3000Lのうち,5%がエタノールなので,3000×0.05=150 より,150Lのエタノールが含まれていることになります。
②
①で計算して出した150L分が全体の70%になればいいので,全体の量(150Lを70%としたときの100%の量)を求めると,150÷0.70=214.4…≒214 より,蒸留液は最大214L手に入れることができることになります。
(4)
蒸留のときに,始めと終わりの分はキレイでないため回収しなかったり,気体のまま液体にならずに逃げて行ってしまう分があるといったことが原因で,基本的に元の液体にふくまれていた分の目的の物質を全部回収することはできません。
そのため,蒸留によって回収できる物質は理想よりも少なくなります。
したがって,実際に回収できた量と計算結果を比べた結果からも,(カ)が正解であることが分かります。
(5)
180L=180000mLであり,これを3mLずつ消費すると,180000÷3=60000 より,60000回分の消毒ができることになります。
(6)
ここでは自分が知っているリサイクルの例をそのまま書けば問題ありません。
本やインターネットなどで,リサイクルの具体的な例をいくつか調べて覚えておきましょう。
まとめ
今回は,物質を分ける方法の1つである「蒸留」についてしょうかいしてきました。
大事なポイントは,「沸点の違い」を利用していること,「沸点の低い物質」を「蒸発させ」て,冷やすことで「キレイな液体」として回収するということです。
他のろ過やクロマトグラフィー,再結晶といった方法と合わせて覚えておきましょう。
また,灯油やガソリンを作ったり,お酒を造るときにも利用されていることと結び付けて覚えることで,より記憶に残りやすくなります。他にもどのようにして物質同士を分けることができるのか考えてみたり調べてみるのも面白いでしょう。


















