物質を加熱すると酸素と結びつく反応が起こります。有機物を燃やすと二酸化炭素が発生するのも炭素Cに酸素O2が結びついてCO2として出てくるからです。問題で取り上げられるものとしては主に金属の粉末などを加熱する実験などが挙げられます。ここでは金属を加熱したときに結びつく酸素の質量について見ていきましょう。
Contents
化合・酸化
化合
物質同士が混ざりあったり,混ざった状態で加熱されたりすると互いに結びついて別の種類の物質ができる化学変化が起きることがあります。このような反応を化合といいます。
化合:2種類以上の物質が結びついて,別の1種類の物質ができる化学変化
化合の例
- 硫黄の蒸気に銅を入れると硫化銅ができる。
銅+硫黄→硫化銅
- 鉄を空気中で加熱すると空気中の酸素と結びついて酸化鉄ができる。
鉄+酸素→酸化鉄
- 鉄の粉末と硫黄の粉末の混合物を加熱すると硫化鉄ができる。
鉄+硫黄→硫化鉄
酸化
化合の中でも特に物質が酸素と結びつく化学反応のことを酸化といいます。酸化は化合の1種です。
酸化:物質が酸素と化合すること
酸化の例
- 水素と酸素を混合した状態で火を付けると爆発的に反応して水ができる。水素+酸素→水
- 木などの有機物を燃やすと、物質中の炭素が酸素と結びついて二酸化炭素ができる。
炭素+酸素→二酸化炭素
- 鉄を空気中で加熱すると空気中の酸素と結びついて酸化鉄ができる。
鉄+酸素→酸化鉄
化学変化と質量
化学変化のとき,化合する物質同士の質量の割合はいつも一定です。
ただし同じ物質同士でいろんな物質ができる場合はその限りではありません。
例えば1000℃以上になると酸化銅が2種類あり,その2種類のできる量の割合によって結びつく酸素の量が変化します。
しかし片方だけしかできてない場合を考えるときは結びつく銅の質量と酸素の質量はいつも一定です。
酸化銅が2種類あることに関しては高校範囲で取り扱う内容なので今は片方の酸化銅のみができていると考えて問題ありません。
金属と酸素の化合の例
- 銅と酸素は質量の比で4:1で結びつく
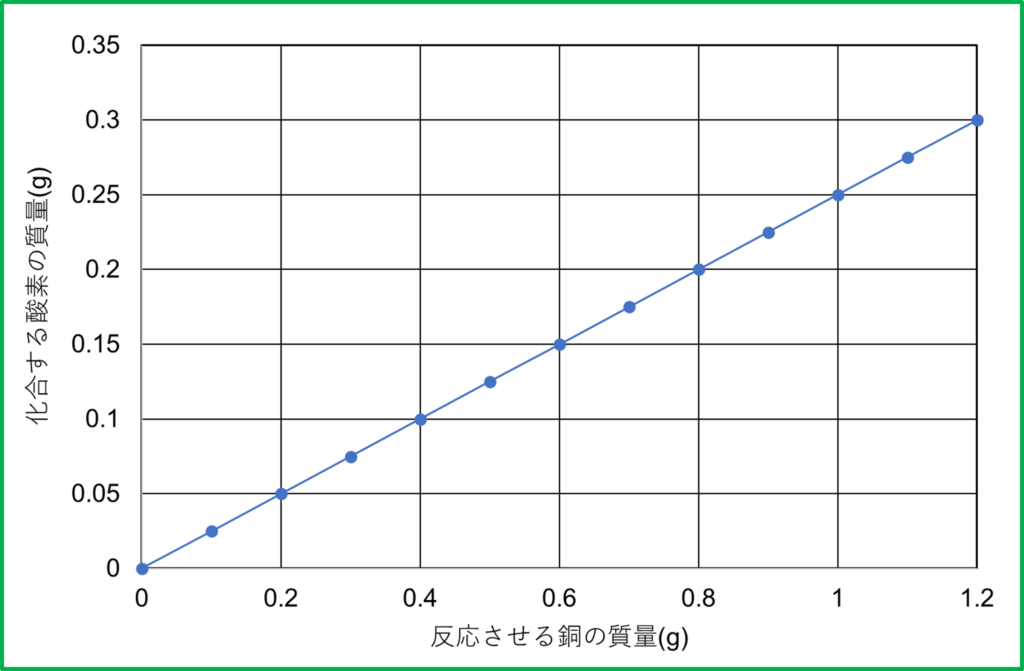
銅の粉末1.2gに対して結びつく酸素は0.3gです。(銅:酸素=1.2:0.3=4:1)
反応が完全に終わっていれば結びつく酸素がこれより多くなったり少なくなったりすることはせず,いつも一定です。
- マグネシウムと酸素は質量の比で3:2で結びつく
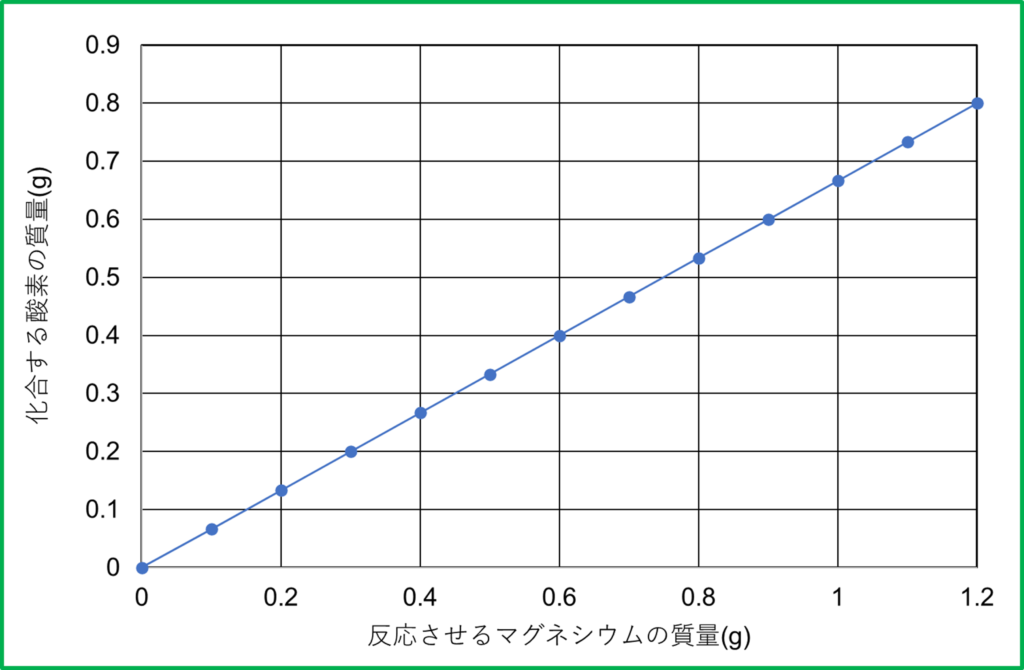
マグネシウムの粉末1.2gに対して結びつく酸素は0.8gです。(マグネシウム:酸素=1.2:0.8=3:2)
問題演習
ここでは銅の粉末を加熱する実験を例に取り上げて,実際に問題を解いてみましょう。
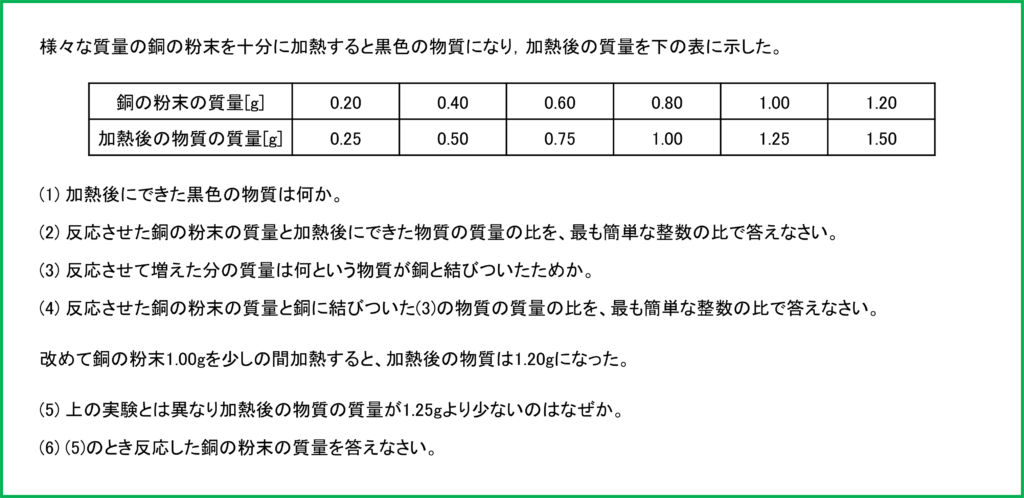
問題
解答
- (1) 酸化銅
- (2) 4 : 5
- (3) 酸素
- (4) 4:1
- (5) まだ酸素と反応せずに残っている銅があるから。
- (6) 0.80g
解説
(1)
銅を加熱すると酸素と結びついて黒色の酸化銅ができる。
(2)
問題の表において銅の質量と酸化銅の質量の比を調べるといずれも4:5となっている。
0.20 : 0.25 = 0.40 : 0.50 = 0.60 : 0.75 = 0.80 : 1.00 = 1.00 : 1.25 = 1.20 : 1.50 = 4 : 5
(3)
(1)の解説にも書いたように,銅は加熱することで酸素と結びつくことで質量が増えた。
(4)
加熱後の物質の質量からもとの銅の粉末の質量を引くことで結びついた酸素の質量を計算することができる。

表の1番上の行と1番下の行の数字の比をとることで反応させた銅の粉末の質量と、反応して結びついた酸素の質量の比を出すことができる。
0.20 : 0.05 = 0.40 : 0.10 = 0.60 : 0.15 = 0.80 : 0.20
= 1.00 : 0.25 = 1.20 : 0.30 = 4 : 1
(5)
加熱が十分でないと銅の粉末が完全には反応せずに残ることがある。この場合反応してない銅が酸素と結びついていないため、本来反応すれば結びつくはずの酸素の質量分だけ加熱後の質量が小さくなる。
(6)
問題文より、加熱後の物質の質量は1.20gである。ここからもともと反応させた銅粉末の質量を引くと、
1.20-1.00=0.20
となるため結びついた酸素の質量は0.20gとなる。
化合において結びつく物質同士の質量の比はつねに同じであるため、(4)より反応する銅と酸素の質量の比は4:1であるから、酸素0.20gと反応した銅の質量は次のように計算できる。
□:0.20=4:1 → □=0.80
したがって反応した銅の質量は0.80gとなる。そして反応せずに残った銅はもともと反応させた1.00gのうち残りの0.20gである。
入試問題演習
実際の入試問題に取り組んでみましょう。
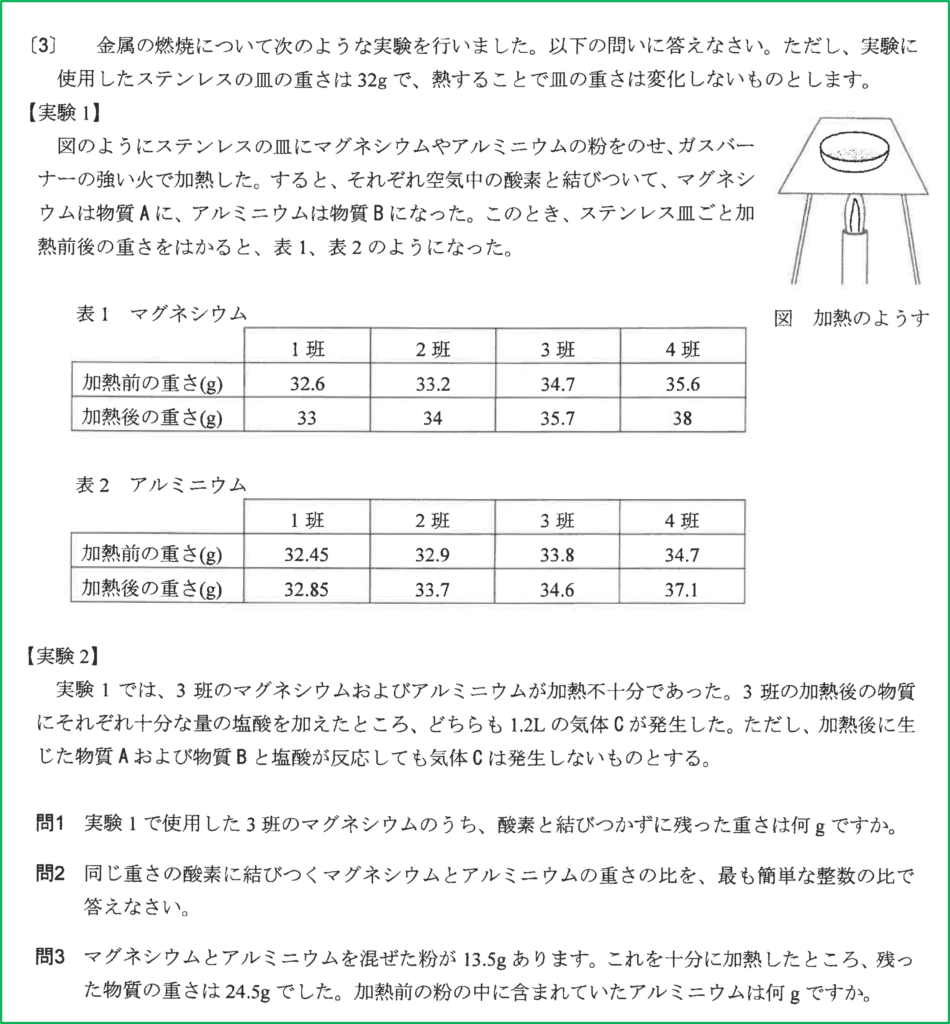
問題
解答
- 問1 1.2 g
- 問2 4:3
- 問3 9g
解説
問1
マグネシウムの粉末を加熱すると、空気中の酸素と結びついて酸化マグネシウムができる。
表1の各値からステンレス皿の重さ32gを引くと、加熱前のマグネシウムの重さと、加熱後にできた酸化マグネシウムの重さが分かる。
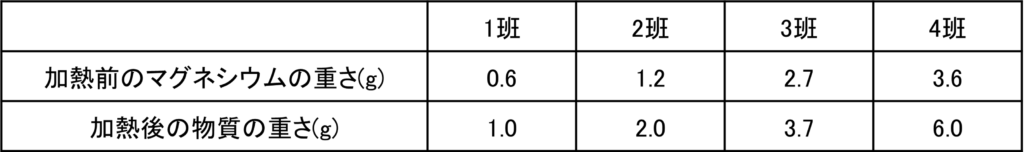
さらに加熱後の物質の重さから加熱前のマグネシウムの重さを引くことで結びついた酸素の重さを計算することができる。
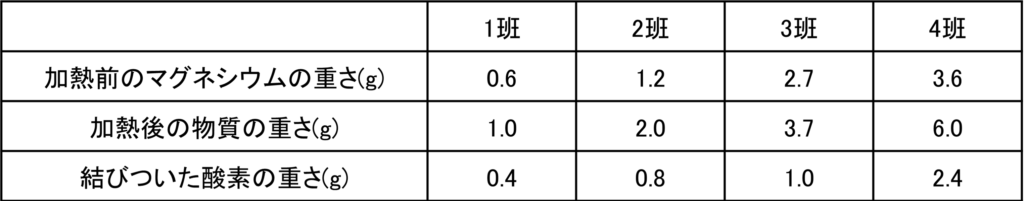
問題文から3班のマグネシウムは加熱が不十分であったことからまだ反応していないマグネシウムが残っていると考えられる。
それで3班以外を考える。3班以外で加熱前のマグネシウムの重さと結びついた酸素の重さの比を計算すると全て3:2となっていることが分かる。
0.6:0.4=1.2:0.8=3.6:2.4=3:2
つまり完全に反応した場合,反応するマグネシウムと酸素の重さの比が3:2であることが分かる。
ここから3班において反応したマグネシウムの重さを計算することができる。3班では結びついた酸素の重さが1.0gだから、反応したマグネシウムの重さは
マグネシウムの重さ:酸素の重さ= □:1.0 = 3 : 2 → □ = 1.5
つまり反応したマグネシウムの重さは1.5gである。
加熱前のマグネシウムの重さ2.7gから反応した分を引くと
2.7 – 1.5 = 1.2
となるから、反応していないマグネシウムの重さは1.2gである。
問2
問1と同じようにアルミニウムの重さと加熱後の物質の重さ,結びついた酸素の重さを計算すると次のようになる。
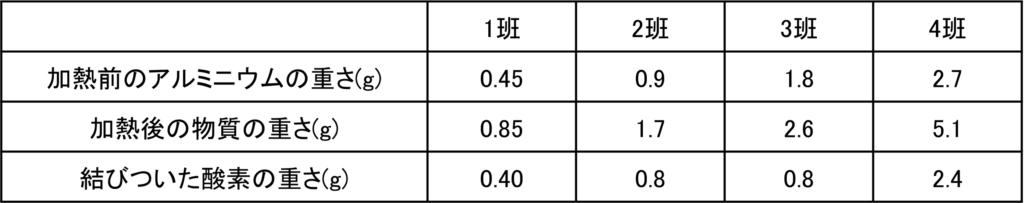
反応が不十分である3班以外を考えると,反応するアルミニウムと酸素の重さの比は、
0.45 : 0.40 = 0.9 : 0.8 = 2.7 : 2.4 = 9 : 8
よって完全に反応した場合、反応するアルミニウムと酸素の重さの比は9:8である。
問1からマグネシウムと酸素の反応する重さの比が3:2だから、これは4倍すると12:8で反応するともいえる。
反応する酸素を8としたとき、反応する酸素とマグネシウムとアルミニウムの重さの比は、
酸素:マグネシウム:アルミニウム = 8 : 12 : 9
したがって同じ重さの酸素に結びつくマグネシウムとアルミニウムの比は12 : 9
最も簡単な整数の比に直すと、4 : 3となる。
問3
マグネシウムとアルミニウムを混ぜた粉の重さが13.5g、加熱後の物質の重さが24.5gであるから、結びついた酸素の重さは次のように計算できる。
24.5 – 13.5 = 11.0
よって11.0gの酸素が結びついたことになる。
加熱前の粉に含まれるアルミニウムの重さを□gとすると、マグネシウムの重さは(13.5 – □)gである。
反応するアルミニウムと酸素の重さの比は9:8だから、アルミニウムに結びつく酸素の重さはもともとあったアルミニウムの重さの9分の8
反応するマグネシウムと酸素の重さの比は3:2だから、マグネシウムに結びつく酸素の重さはもともとあったマグネシウムの重さの3分の2
つまり結びつく酸素の量は合計して次のように書ける
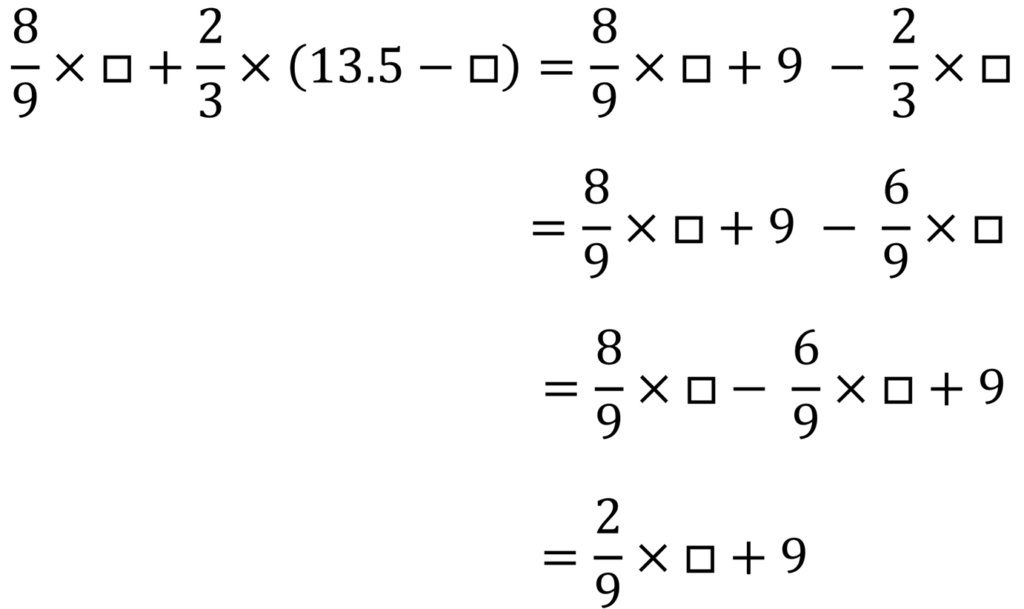
実際に結びついた酸素は11gだから、
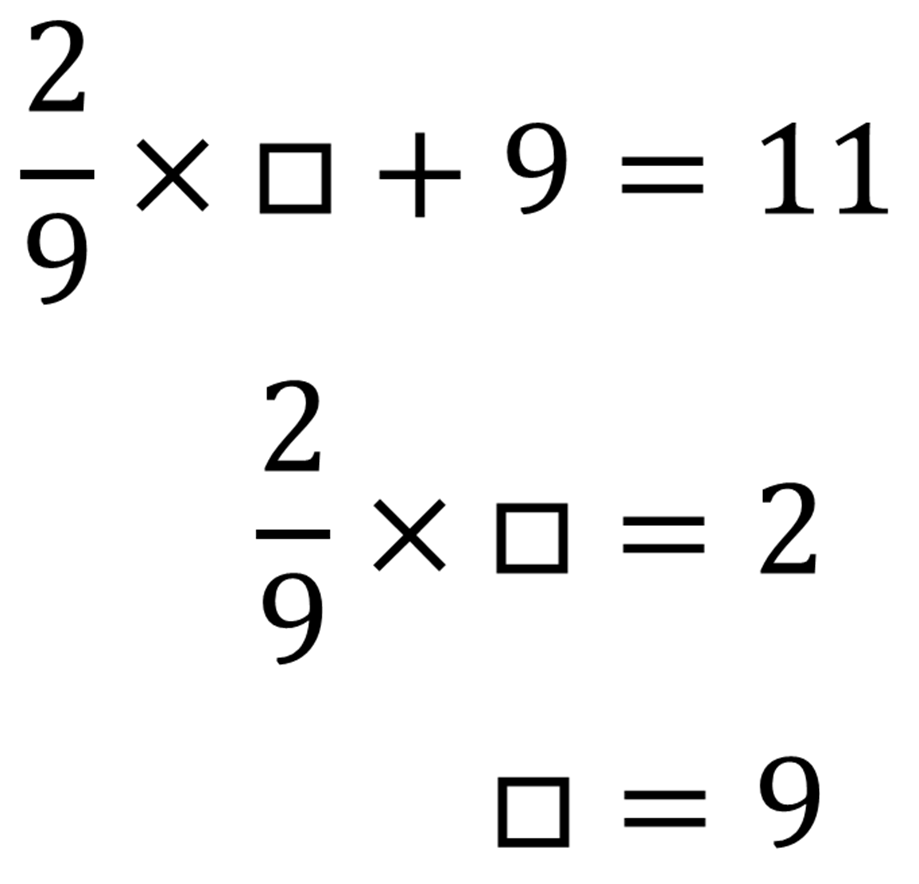
したがって反応前の粉に含まれていたアルミニウムの重さは9gである。
まとめ
難しい学校となると□を使った計算、つまり方程式の考え方を使わなければ解けない問題も出てきます。理科の力を高めるためには算数の力も必要です。化合と質量の関係をしっかり整理したうえで物質の重さを求める計算力もつけましょう。

















