水溶液・溶解度の問題は入試出題頻度の高い内容です。これを完璧にすると大問ひとつまるまる解けるようになります。
解き方に慣れるまで例題の基礎問題を繰り返して、最後入試過去問題に取り組みましょう。用語は覚えるというよりは理解し、実際にその状況がイメージできることが望ましいです。
問題解くポイントは自分が実験しているようかのようにイメージすることです。難しい問題になればなるほどこのポイントが大切になります。その際に問題文を図にかいたり、表にまとめると理解しやすいでしょう!
では内容解説、例題を解いてみましょう!
Contents
水溶液の濃さ
水溶液
物が水に溶けると、透明っでどこも同じ濃さになり、長い時間置いても、ろ過しても、水と溶けている物とを分けることは出来ません。
砂糖が水に溶けるとき、砂糖をつくっているつぶが、水の中で一つ一つに分かれて、水のつぶと均一に混ざります。このつぶはとても小さいので、ろ紙の隙間を通り抜け、底にしずむこともありません。
このように、物質が小さなつぶになって、水のような液体のつぶとまざることを、溶解といいます。
※水溶液の問題を考えるにあたって、上記のように溶かすもの(水)、溶けるもの(砂糖)を”つぶ”と可視化して考えると分かりやすいです。
◎用語まとめ
- 溶液 : 液体にある物質が溶けたもの 例)砂糖水
- 溶質 : 溶かされている物質 例)砂糖
- 溶ばい : 溶かしている液体 例)水
この用語がなにを示しているか理解するまでは、例の砂糖水に置き換えて考えてみるとわかりやすいです。溶液と問題に記載があれば、砂糖水のこと〜などを置き換えると少し問題をイメージしやすいのではないでしょうか。
溶液の濃さ
溶液の濃さは、溶液全体の重さに対して、溶質がどんな割合になっているかで表します。全体を100としたときの割合であるパーセント(%)で表します。
⇨砂糖水で置き換えて読みかえると…
砂糖水の濃さは、砂糖水全体の重さ(g)に対して、砂糖がどの割合で存在しているかで表します。
【公式】
\(溶液の濃さ(%)=\frac{溶質の重さ(g)}{溶液の重さ(g)}\times100=\frac{溶質の重さ(g)}{溶ばいの重さ(g)+溶液の重さ(g)}\times100\)※溶液(砂糖水)の重さ=溶ばい(水)の重さ+溶質(砂糖)の重さ
を表しています。
まずは基礎の問題を解いて解き方のルーティンを作りましょう!
【例題1】
100gの水に、25gの砂糖を溶かした砂糖水の濃さは何%か
⇨解き方①
- ①溶液、溶質、溶ばいがそれぞれ何か・何gなのかを箇条書きする。
- 溶媒:水 100g
- 溶質:砂糖 25g
- 溶液:砂糖水 125g(100g+25g)
- ②公式に代入or溶液全体の重さ(125g)に対しての溶質の重さ(25g)の割合×100}
(どちらも同じです。後者は公式の説明です。)
よって
\(\frac{25}{125}\times100=20(\%)\)
となります。
①で必要な条件を自分で整理することが大切です。公式にいれればいいという考えはやめて、何の重さを示しているのかを明確にすることから始めましょう!
溶液の濃さの応用
入試などでは溶液の濃さを求められる、または公式を覚えていることは当たり前です。この知識をどうやっていかしていけるかが重要なのです。
溶液の濃さから溶質/溶ばいの重さを求める問題
【例題2】
20%の食塩水を150gつくるには、何gの水に、何gの食塩を溶かせばよいですか。
⇨解き方
- ①必要な条件を自分で整理する
-
- 溶液、溶質、溶ばいがそれぞれ何か書き出す
溶液:食塩水 溶質:食塩 溶ばい:水
- 溶液、溶質、溶ばいがそれぞれ何か書き出す
-
- 濃度の濃さは全体を1として必要な溶質の割合を考え直す
20%というのは全体を100としたときの値なので
全体を1とすると\(\frac{20}{100}=0.2\)になります。
- 濃度の濃さは全体を1として必要な溶質の割合を考え直す
- 食塩水は150g
-
- ②条件を使って計算する
食塩水150gのとき、食塩がこれの0.2倍必要なので
\(150(g)\times0.2=30(g)\)
そして
溶液(食塩水)150g 溶質(食塩)30g 溶ばい(水)?g
ということで
\(150(g)-30(g)=120(g)\)
となり、ちなみに水の量は溶液全体の80%(0.8倍)にあたります。
溶液の濃さが変わる問題
【例題3】
20%の食塩水100gを5%にうすめるには、何gの水を加えればよいですか。
◎解き方1
|
濃度 |
食塩水(g) |
食塩(g) |
水(g) |
|
20% |
100g |
(ⅰ) |
|
|
5% |
(ⅲ) |
(ⅱ) |
|
このように表をつくり整理するとわかりやすいです。
参考書では表を記載してくれているものもありますが、入試ではこのように問題分のみです。その際自分で表を書いて整理することが大切です。
表の(ⅰ)~(ⅲ)を埋めていこう!
- (ⅰ)20 %の食塩水100gに含まれる食塩の量を求めよう。
公式より、
\(100\times0.2=20(g)\) - (ⅱ)食塩の量は20%も5%のときも変わらない(水しか加えない)ため20(g)
- (ⅲ)表をもう一度整理して食塩水の重さを求める
|
濃度 |
食塩水(g) |
食塩(g) |
水(g) |
|
20% |
100g |
20 |
100-20=80g |
|
5% |
(ⅲ) |
20 |
|
公式より
\(\frac{20}{0.05}=400(g)\)|
濃度 |
食塩水(g) |
食塩(g) |
水(g) |
|
20% |
100g |
20g |
80g |
|
5% |
400g |
20g |
400-20=380 |
食塩水の重さまたは水の重さで比較すると300g水を足せば良いことがわかる。
よって300gの水を加える
◎解き方2
20%の食塩水を5%にうすめることを”4倍(20÷5)にうすめる”といいます。
4倍にうすめるというのは、食塩水全体の量が4倍になることをいいます。
このため、20%の食塩水の3倍(4-1)の水を加えることになります。
\(100\times(4-1)=300(g)\)解き方2のほうが単純な計算で済むので、解き方2を理解し、こちらを使うことをおすすめします。(解き方1を理解した上でつかってください)
濃度の違う溶液を混ぜる問題
【例題4】
20%の砂糖水100gと、8%の砂糖水200gを混ぜると、何%の砂糖水になりますか。
◎解き方1
表を作って整理していく
|
濃度 |
砂糖水(g) |
砂糖(g) |
水(g) |
|
20% |
100g |
(ⅰ) |
|
|
8% |
200g |
(ⅱ) |
|
|
★% |
100+200=300g |
(ⅰ)+(ⅱ) |
|
20%の砂糖水に含まれる砂糖の重さは
\(100\times0.2=20(g)\)…(ⅰ)8%の砂糖水に含まれる砂糖の重さは
\(200\times0.08=16(g)\)]…(ⅱ)よって混ぜた砂糖水に含まれる砂糖の重さは
(ⅰ)+(ⅱ)\(=20+16=36\)
|
濃度 |
砂糖水(g) |
砂糖(g) |
水(g) |
|
20% |
100g |
20g |
|
|
8% |
200g |
16g |
|
|
★% |
100+200=300g |
36g |
|
よって公式から濃度を求める
\(\frac{36}{300}\times100=12\%\)◎解き方2
この砂糖水をどんな割合で混ぜたとしても、必ず8%よりも濃く、20%よりも薄くなるはずです。このことからてんびんのつりあいで考えることが出来ます。
以下の図を参照して解いてみましょう!

図1 例題4解き方2 てんびんのつりあいでの考え方
12目もり(20%-12%)のぼうの左右におもりをつるし、つり合うときの支点の位置を求めます。
左側のおもりの重さは、右側の2倍なので、左側のおもりから支店までの長さは、右側の半分でよいことになります。
\(8+(12\div3)=12(\%)\)※ 3というはおもり全体で300gあるところの100g分を表した3です。(300g/100g)
または
\(20-(12\times\frac{2}{3})=12(\%)\)体積を求める問題
液体の量は、重さをはかるより体積をはかった方があつかいやすいので、うすめるときは、体積をはかる方法がよく使われます。
実際に実験をしてみると液体をはかりとるときにはビーカーやこまごめピペット、メスピペットを使って実験すると思います。
ただし、濃さは重さをもとにして表されている(公式も単位はgグラムですよね)ので、体積と重さとの関係をはっきりさせておかなければいけません。
【例題5】
125㎤の水に、35%の濃い塩酸を加えて、10%のうすい塩酸をつくろうと思います。濃い塩酸は何㎤加えればよいですか。ただし、35%の塩酸1gは、体積では0.85㎤にあたります。
35%を10%にうすめるには、重さで2.5倍(\(35\div10-1\))の水が必要です。
体積125㎤の水の重さは125g (水は1gで体積1㎤でよい)ですから、35%の塩酸は50g(\(125\div2.5=50\))必要です。
塩酸50gを体積に変換すると\(0.85\times50=42.5\)㎤
よって125㎤の水に、35%の塩酸を42.5㎤加えると、10%のうすい塩酸ができます。
溶解度
一定量(ある決まった量)の水に、いろいろな物を入れて、よくかき混ぜてみます。このとき、まったく溶けない物、溶ける限度のある物、無制限に溶ける物があります。
一定量(ふつう100g)の水に対して、溶ける限度のある物が、最大限どれだけ溶けるかを表す数値を、水に対するその物質の溶解度といいます。溶解度は、水の温度によって変わります。
溶質による溶解度のちがい
- 一定量の水に溶けやすい物: 砂糖・食塩
- 溶けづらい物:ホウ酸・水酸化カルシウム(消石灰)
→溶質には溶けやすい物と溶けにくい物がある。
◎ほう和水溶液(飽和水溶液)
溶質に水を溶かしていくと、それ以上溶かすことができない限度に達します。
このとき、限度に達することをほう和といい、限度いっぱいに溶かした溶液をほう和水溶液といいます。そして、水100gにほう和する溶質の重さを溶解度とします。
温度による溶解度のちがい
- 固体が水に溶ける場合
基本的に水の温度が高くなるほど溶解度は大きくなります。冷たい紅茶では角砂糖(固体の砂糖)はあまり溶けないですよね!!
しかし例外として水酸化カルシウムのように温度が高くなると溶解度が小さくなる物質もあります。 - 液体が水に溶ける場合
液体には、水に無制限に溶けるモノと、まったくあるいはほとんど溶けない物とが多くあり、溶ける限度をもった物は、わたしたちのまわりには、あまり多くありません。
無制限に溶ける物:アルコール※、酢酸、グリセリン、過酸化水素など
※アルコール
例)メタノール(=メチルアルコール)→燃料として使われる
エタノール(=エチルアルコール)→消毒・飲料として使われる
溶ける限度のある物:エチルアルコール→ますいなどに使われる
クレゾール→消毒などに使われる - 気体が水に溶ける場合
すべての気体は、水に溶ける限度量があります。気体の溶解度は水1㎤にそれぞれの気体を何㎤溶かすことができるかで表します。
気体が水に溶ける限度量は温度が高くなるほど少なくなります。
また、気体が水に溶ける時に大きく関係するものがもう1つあります。それは圧力です。気体に圧力をかければかれるほど気体は多く溶けます。
炭酸飲料のせんをぬくとあわがたくさんでてきますよね。これはビンの中で気体を溶かし込んでいた大きな圧力が、せんをぬくことで空気中の圧力(大気圧)と同じになってしまうため、二酸化炭素が溶けていることができなくなってしまうからです。
|
溶質(㎤)/温度(℃) |
0 |
20 |
40 |
60 |
80 |
100 |
|
アンモニア |
1176 |
702 |
– |
– |
– |
– |
|
塩化水素 |
507 |
442 |
386 |
339 |
– |
– |
|
塩素 |
4.61 |
2.30 |
1.44 |
1.02 |
0.68 |
0.00 |
|
二酸化いおう |
80 |
39 |
19 |
– |
– |
– |
|
二酸化炭素 |
1.71 |
0.88 |
0.53 |
0.36 |
– |
– |
|
酸素 |
0.049 |
0.031 |
0.023 |
0.019 |
0.018 |
0.017 |
|
空気 |
0.029 |
0.019 |
0.014 |
0.012 |
0.011 |
0.011 |
|
ちっ素 |
0.024 |
0.016 |
0.012 |
0.010 |
0.0096 |
0.0096 |
|
水素 |
0.022 |
0.018 |
0.016 |
0.016 |
0.016 |
0.016 |
表 気体の溶解度
溶解度のちがいを利用しよう!
①温度による溶解度のちがいを使う方法
【溶質が1種類のとき】
ホウ酸は、水の温度がちがうと溶解度が大きく変化します。このような物質を高温でたくさん溶かし、その水溶液の温度を下げていくと溶けることができなくなった物質の結晶が多くあらわれます。この液をろ過すればたくさんの溶質を取り出すことができます。
【溶質が2種類のとき】
ホウ酸と食塩のように、温度による溶解度がかなりちがう2種類の物質が混ざっているとき、温度を下げると溶解度の小さい物質(ホウ酸)が先にほう和水溶液になります。さらに温度を下げると、その物質(ホウ酸)の結晶があらわれてきます。
②溶ばいを蒸発させる方法
食塩のような水に対する溶解度が温度によってあまり変わらない場合はどうするか?
→溶液を蒸発皿にとり、熱して水を蒸発させます。溶ばいである水を減らしていけばいいのです。
入試問題にトライ!!2020年 早稲田中学校
問い 下表は、いろいろな温度で、100gの水に溶けるだけ溶かした食塩、砂糖、ホウ酸、硝酸カリウムの量を示したものです。以下の問いに答えなさい。
|
水の温度(℃) |
20 |
40 |
60 |
80 |
|
食塩(g) |
35.8 |
36.3 |
37.1 |
38.0 |
|
砂糖(g) |
203.9 |
238.1 |
287.3 |
362.1 |
|
ホウ酸(g) |
4.9 |
8.9 |
14.9 |
23.5 |
|
硝酸カリウム(g) |
31.6 |
63.9 |
109.2 |
168.8 |
⑴40℃の水50gに食塩20gを加えてよくかきまぜ、溶けるだけ溶かしました。溶けずに残った食塩の重さは何gですか。
⇨解説
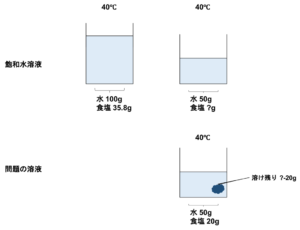
図2 ⑴解説図
表は100gの水に最大限溶かした量、つまり溶解度を表しています。表によると食塩は40℃で100gの水には36.3g溶けることができます。
水50gですと食塩はその半分の18.15g溶けることができます。
今、問題では20gを加えていて、溶けることができた食塩は18.15gなので
\(20-18.15=1.85(g)\)よって1.85gが溶け残る。
⑵80℃の水100gに硝酸カリウム40gを加えてよくかきまぜ、溶けるだけ溶かしました。この水溶液を20℃まで冷やすと何gの結しょうが出てきますか。
⇨解説
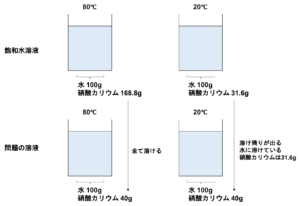
図3 ⑵解説図
まずは硝酸カリウムの溶解度を確認しましょう。
80℃の水100gに硝酸カリウムは168.8g溶けることができます。
なので問題の40gは溶けきっていることがわかります。(溶け残りはないということ)
そして20℃の水100gには硝酸カリウムは31.6g溶けることができます。
40gの硝酸カリウムが入っていた溶液なので
\(40-31.6=8.4(g)\)8.4gが結しょうとしてでてきます。
⑶40℃の水100gが入ったビーカーを4つ用意しました。食塩、砂糖、ホウ酸、硝酸カリウムを40gずつはかり、それぞれ別のビーカーに加えてよくかきまぜました。次のうち正しいものはどれですか。ふさわしいものを全て選び記号で答えなさい。
- ア. ホウ酸を加えたビーカーには溶け残りができる。
- イ. 4つのうち、2つのビーカーの水溶液は同じ濃さである。
- ウ. 4つのビーカーを20℃まで冷やすと、すべてのビーカーに溶け残りができる。
- エ. 4つのビーカーを60℃まで温めてよくかき混ぜると、1つのビーカーにだけ溶け残りができる。
⇨解説
|
水の温度(℃) |
40 |
|
食塩(g) |
36.3 |
|
砂糖(g) |
238.1 |
|
ホウ酸(g) |
8.9 |
|
硝酸カリウム(g) |
63.9 |
まず、
- ア. ホウ酸を加えたビーカーには溶け残りができる。
表によるとホウ酸は40℃で100gの水には8.9g溶けることができます。
ホウ酸40gいれますと溶けきれないものがでてきてしまうので○ - イ.4つのうち、2つのビーカーの水溶液は同じ濃さである。
ホウ酸は溶け残りがある=溶解度にて水溶液がほう和水溶液となるということです。
ということは、濃さは
\(\frac{8.9}{100+8.9}\times100(\%)\)
となります。
食塩もホウ酸と同様に溶け残ってしまうので、濃さは
\(\frac{36.3}{100+36.3}\times100(\%)\)
となります。
以上計算はしなくてよいでしょう。
砂糖と硝酸カリウムは40g以上溶けることができますが、今問題では40gしか加えていないので濃度は
\(\frac{40}{100+40}\times100(\%)\)
となります。
よって2つのビーカーの水溶液は同じ濃さである。は◯となります。 - ウ. 4つのビーカーを20℃まで冷やすと、すべてのビーカーに溶け残りができる。
|
水の温度(℃) |
20 |
|
食塩(g) |
35.8 |
|
砂糖(g) |
203.9 |
|
ホウ酸(g) |
4.9 |
|
硝酸カリウム(g) |
31.6 |
表をみて20℃で100gの水に溶質が40g溶けることができるかできないかで判断しましょう。
まず、
- ホウ酸と食塩; 40℃の水にも溶け残っていました。
- 硝酸カリウム; 20℃の水100gには最大で31.6g溶けます。
そうすると40gは溶けきることができず8.4g結晶としてでてきてしまいます。
- 砂糖; 砂糖は20℃の水100gに最大で203.9g溶けます。40gの砂糖はすべて溶けることができます。
よって砂糖40gすべて溶けるので×
- エ.4つのビーカーを60℃まで温めてよくかき混ぜると、1つのビーカーにだけ溶け残りができる。
|
水の温度(℃) |
60 |
|
食塩(g) |
37.1 |
|
砂糖(g) |
287.3 |
|
ホウ酸(g) |
14.9 |
|
硝酸カリウム(g) |
109.2 |
表をみて60℃で100gの水に溶質が40g溶けることができるかできないかで判断しましょう。
- 食塩; 60℃の水100gには最大で37.1g溶けます。
ということは40gの食塩は溶け残りができてしまいます。 - 砂糖; 60℃の水100gには最大で287.3g溶けます。
ということは40gの砂糖はすべてとけきることができます。 - ホウ酸; 60℃の水100gには最大で14.9g溶けます。
ということは40gのホウ酸は溶け残りができてしまいます。 - 硝酸カリウム; 60℃の水100gには最大で109.2g溶けます。
ということは40gの硝酸カリウムはすべてとけきることができます。
よって2つのビーカーに溶け残りができるので×
答えはア、イ
⑷20℃の水にある量の食塩をいれてよくかきまぜたところ、溶け残りが生じたので、これをろ過しました。溶け残った食塩をのせたろ紙をろうとから外し、十分に乾燥させてから重さをはかると、ろ紙のみの重さから2.1g増えていました。また、ろ過してから得られた液体(ろ液)が67.9gでした。最初に入れた食塩は何gですか。ただし、ろうとに食塩水は残っていないものとします。
⇨解説
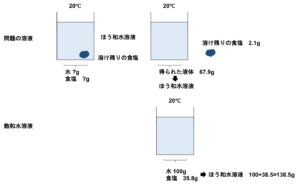
図4 ⑷解説図①
まずは問題文を読み解くことが大切です。
- 「溶け残りが生じたので」
→溶液はほう和している。 - 「溶け残った食塩をのせたろ紙をろうとから外し、十分に乾燥させてから重さをはかると、ろ紙のみの重さから2.1g増えていました。」
→溶け残った食塩の重さは2.1gである。 - 「ろ過してから得られた液体(ろ液)が67.9gでした。」
→20℃でのほう和水溶液の重さが67.9gである。
20℃の水100gは食塩35.8g最大で溶けることができ、この溶解度でのほう和水溶液の重さは\(100+35.8=135.8g\)です。
よってほう和水溶液135.8gのとき、食塩は35.8gであります。
ほう和水溶液67.9gのときは食塩は何グラムであるか求めます。
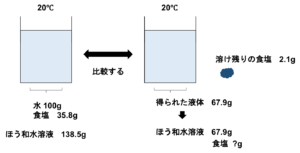
図5 ⑷解説図②
ほう和水溶液は半分の重さになっているので食塩も半分の重さになり、17.9gとなります。
最後にろ紙に残っていた食塩2.1gを足して20gとなります。
よって最初に入れた食塩は20gとなります。
おわりに
溶解度、加えた溶質の量、溶け残りの量などを整理して考えることが大切なのがわかりますね。
理科の問題では(特に水溶液では)表にある数字をどう使うのか、どれを使うのか、何を意味しているのかを理解することが大切になります。
最初に言いましたが、実際に問題でしていることをイメージできるとすらすらと問題が解けるようになりますよ!


















