水が沸騰する温度は100℃で,水が氷になる温度は0℃というのが当たり前になっていませんか?
しかし多くの場合,実際に水の沸騰が始まるのは100℃より高い温度になったり,水を氷にするために0℃より低い温度まで冷やさなければいけなければなりません。
それは水の中に不純物があるからです。
皆さんが知っている沸点や凝固点の温度は,水の中に何も入ってない状態,すなわち純粋な水の場合を言っています。
水の中に何かが溶けることによって,沸点や凝固点の温度は変化してしまうのです。
この記事ではどうして何かを溶かすことが沸点や凝固点に影響を与えるのかという点について,分かりやすく紹介していきます。
(注意)ここでの説明には,厳密に言うと化学的に正しくない部分が一部含まれます。あくまでも簡単なイメージをつかむための説明としてご覧いただければ幸いです。
Contents
沸点が上がる現象
蒸発では何が起こっているか
まずは蒸発という現象についておさらいしましょう。
「蒸発」といえば,「液体が気体になる」現象のことですが,ここではもっと小さな世界で,水の粒どうしというレベルで何が起こっているのかを知る必要があります。
蒸発という現象の中で水の粒に何が起こっているのか,確認していきましょう。
ここではまず,水を含めたあらゆる物質は粒でできているという知識を前提としています。
水が粒…?という感覚になっている方や状態変化について復習しておきたい方はこちらの記事を参考にしてください。
「水と氷の間の状態変化~”状態変化の正体”と”物質の体積や密度の変化”との関係について知ろう~」
https://chugaku-juken.com/water-ice/
まず,物体の温度というものは,その物体を作っている粒がどれだけ激しく動けるかを表す目安になっています。そして粒同士は弱いながらもお互いを引っ張ろうとします。
温度が低く液体となっている状態では,ほんの少しは動けるけれども,お互いを引っ張る力を振り切れるほどは動けないのです。
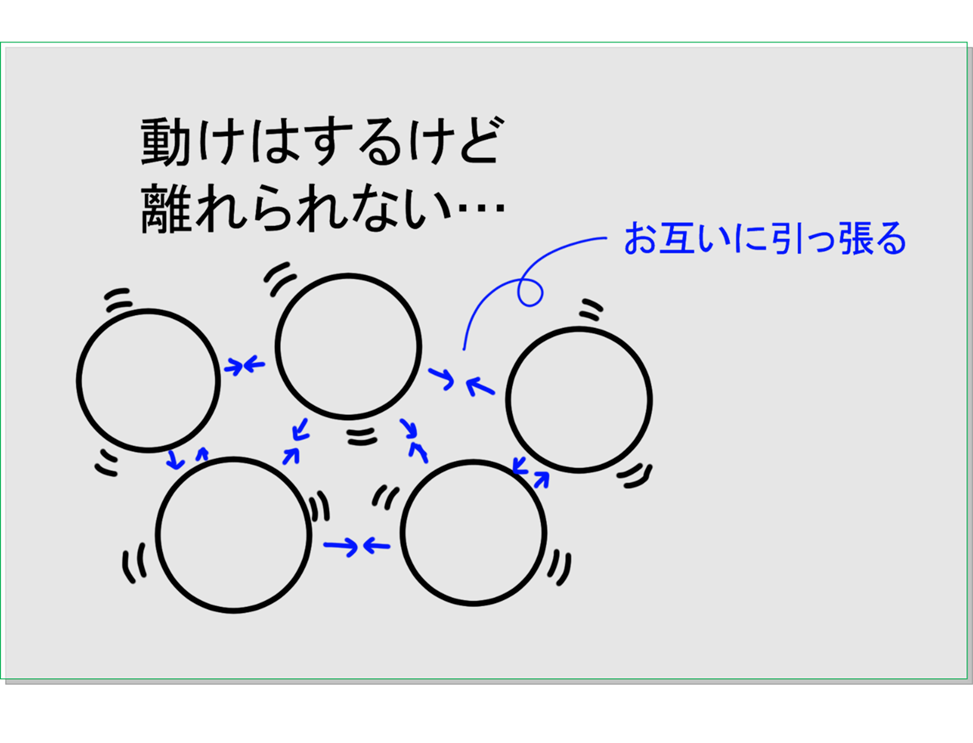
ここから温度を上げていくと,この粒がより激しく動けるようになります。すると特に動きの激しい粒は,お互いに引っ張る力を振り切って,外へ飛び出していくのです。これをくりかえすことで粒たちがそれぞれ互いに離れて自由に動き回れるようになります。
これが「蒸発」という現象です。
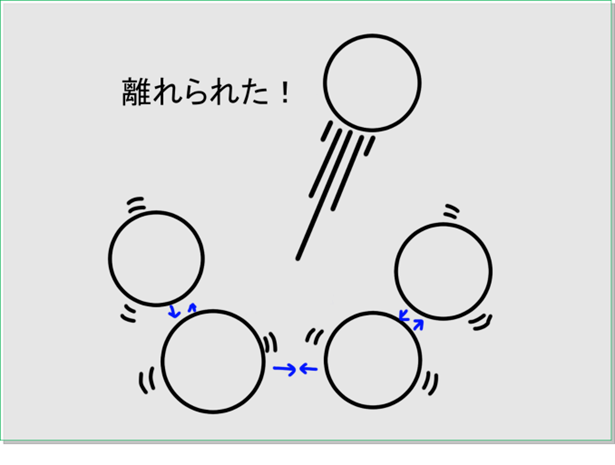
ここでは小さな世界で見た蒸発という現象について説明しました。
次からは,この水の粒の中に何かを溶かすことを考えていきます。
水の中に物質を溶かすと沸点が上がる
さて水の粒の中に,別のものが混ざっていたらどうなるでしょうか。
キレイな水は100℃で沸騰という現象が起きますが,水の中に何かが溶けているとそうはいきません。
結論から言ってしまうと,水の中に物質を溶かすと,沸点が上がります。
例えば水の中に塩を溶かすことで,沸点が101℃になったりするイメージです。
それでは何かを溶かすとなぜ沸点が上がってしまうのかを説明していきましょう。
まずは何も混ざっていない水と,何かが混ざっている水,つまり水溶液の水面の様子を簡単に表したものを下の図に示してみましたので,比べてみてください。
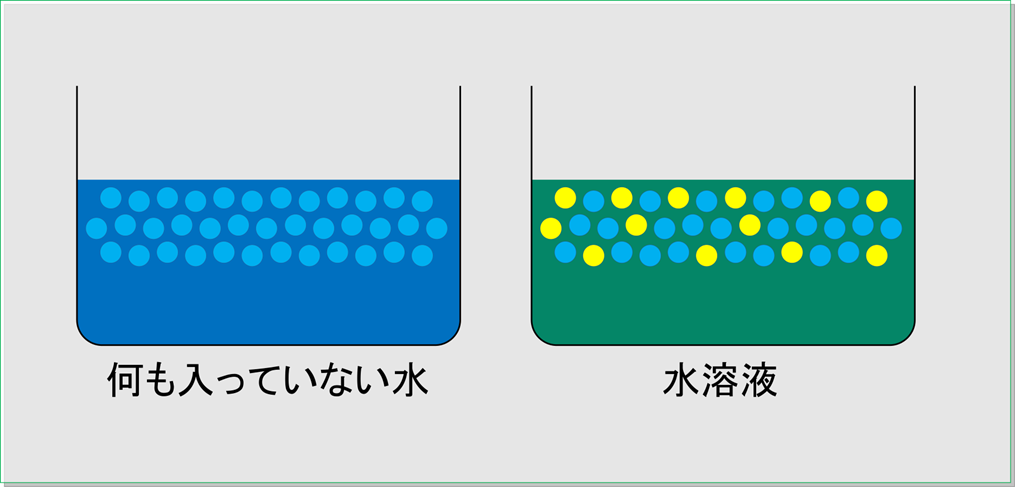
図の青い粒が水の粒を表していて,黄色の粒は水に溶けている物質の粒を表します。
何も入っていない水と水溶液の水面近くを比べたとき,水溶液では水の粒の数が少ないのが分かるでしょうか。
外へ飛び出そうにも,溶けている物質の粒がジャマになっているのです。
つまり溶けている物質がジャマで蒸発しづらい状況になっているわけです。
そのため水溶液の水が蒸発するには,このジャマな粒さえも振り切って飛び出していかなければならず,より激しく動かなければなりません。
そのため必要な温度が上がってしまうのです。
こうして沸点が上がるという結果につながっているのです。
このような現象を「沸点上昇」と呼びます。
そしてもちろんジャマな粒が多いほど,水の粒は飛び出しづらくなります。
沸点が何度上がるかは,溶かしている物質の重さに比例します。何かを溶かす量が多くなるほど,水の沸点も上がっていくのです。
外の圧力と沸点
さて,ここまで水に物質を溶かした量と沸点の関係について紹介してきました。しかし沸点は空気の圧力の大きさにも影響されます。蒸発や沸騰と圧力の関係について簡単に紹介していきましょう。
まず蒸発と圧力の関係の方について見ていきましょう。
水面の近くには,まだ蒸発したばかりの水の粒が飛び回っています。しかし飛び回っている水の粒の速さはバラバラです。そしてときにはこの水の粒が水面に当たってしまうこともあるでしょう。このとき粒の速さが遅いと,再び水面にある水の粒に引っ張られて液体の仲間に引き戻されてしまいます。
ここで圧力が高いほど,水の粒が水面に当たる回数は多くなるため,より液体に戻されやすくなります。すると蒸発する方の水の粒の数を増やすためには,より温度を上げることで水の粒の運動を激しくしてやる必要が出てくるのです。
次に沸騰と圧力の関係について説明します。
沸騰では水の中でも蒸発という現象が起きることで泡が発生します。
さて,ここで1つ考えなければいけないことがあります。
目には見えませんが,水面は空気によって上から押されているということです。せっかく水の中に泡ができても,上から空気や水によって押されてしまうとすぐにつぶされてしまいます。
これを防ぐためには,泡の中の水の粒がより激しく動くことで外からの圧力に対抗しなければいけません。
外からの圧力が強くなるほど,必要な激しさは増えていきます。そのため沸騰するための温度も上がっていくのです。
このようにして,外からの圧力が上がれば上がるほど,沸点は上がっていきます。逆に,外の圧力が大気圧よりも低くなると,沸点は100℃よりも低くなる点にも注目です。
凝固点降下
次に凝固点,すなわち「液体が固体になる温度」が変化する現象について紹介しましょう。
簡単な原理としては,沸点上昇のときと大体同じイメージになります。
水が固まるときも,温度が下がることで水の粒の運動がどんどん静かになり,近くに集まってほんの少し振動するだけになります。
ここで水に何かが溶けていると,粒どうしが集まるうえで,その溶けている物質の粒がジャマなのです。
ここでより温度を低くすることで集まりやすくしてやる必要があり,凍るための温度がいつもよりも低くなるというわけです。
この現象を「凝固点降下」と呼びます。
凝固点降下の利用
この凝固点降下という現象は,冬に氷を解かすための融雪剤に利用されています。
雪の上に融雪剤をまくと,まず雪の水分に溶けます。物質は溶けるときに熱が発生するので,この熱で雪が解けます。これをくりかえすことで雪が解けていきます。さらに解けて水になると融雪剤がそこへ溶けることで濃度が上がるため,凝固点が下がり,再び凍りにくくなるのです。そのため凍結防止剤としても使われています。
入試問題演習
ここまでで学習したことを活かして,実際の入試問題にチャレンジしてみましょう。
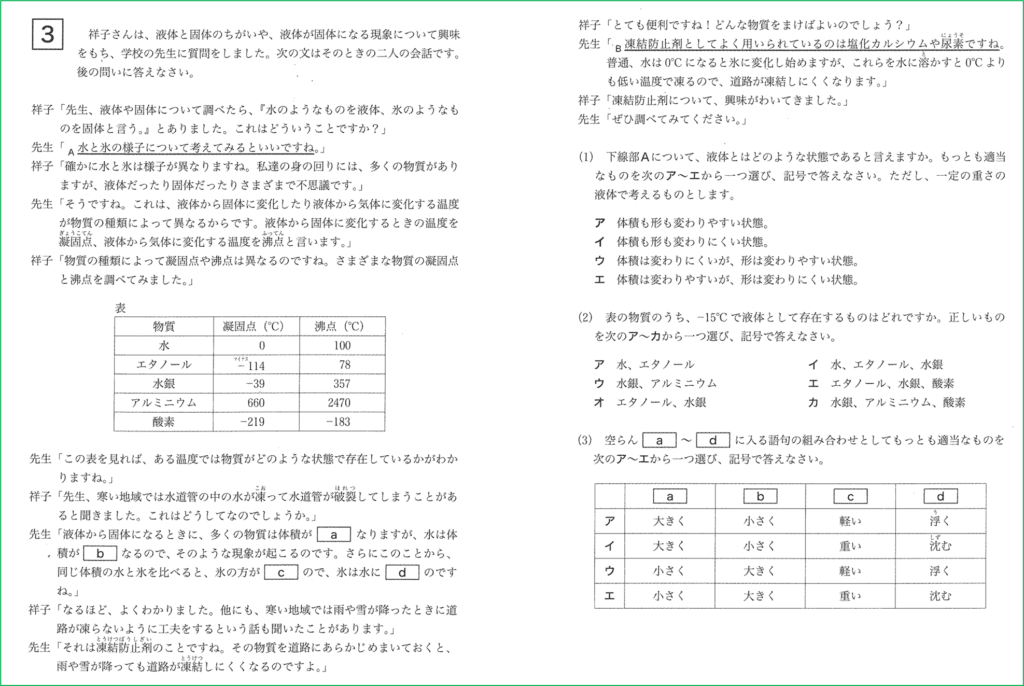
問題

解答
- (1) ウ
- (2) オ
- (3) ウ
- (4) マイナス5℃
- (5) 15.6g
- (6)
- (7) エ
解説
(1)
液体では物質の粒同士がなかなか離れられない状態なので,体積は変化しにくい状態です。
また,液体は流動性があり,形が変わりやすい状態であるのは皆さんもご存じのことだと思います。
つまり,ウが正解となります。
(2)
-15℃で液体であるためには,凝固点が-15℃よりも低く,沸点が-15℃よりも高い必要があります。表の物質の中でこれを満たすのはエタノールと水銀だけです。つまり,オが正解となります。
(3)
問題文の通りです。
普通は物質の体積は温度が高くなるほど大きくなりますが,水は例外で,氷になることで体積が増えます。その理由について詳しく知りたい方は上で紹介した状態変化についての記事を参考にしてください。
(4)
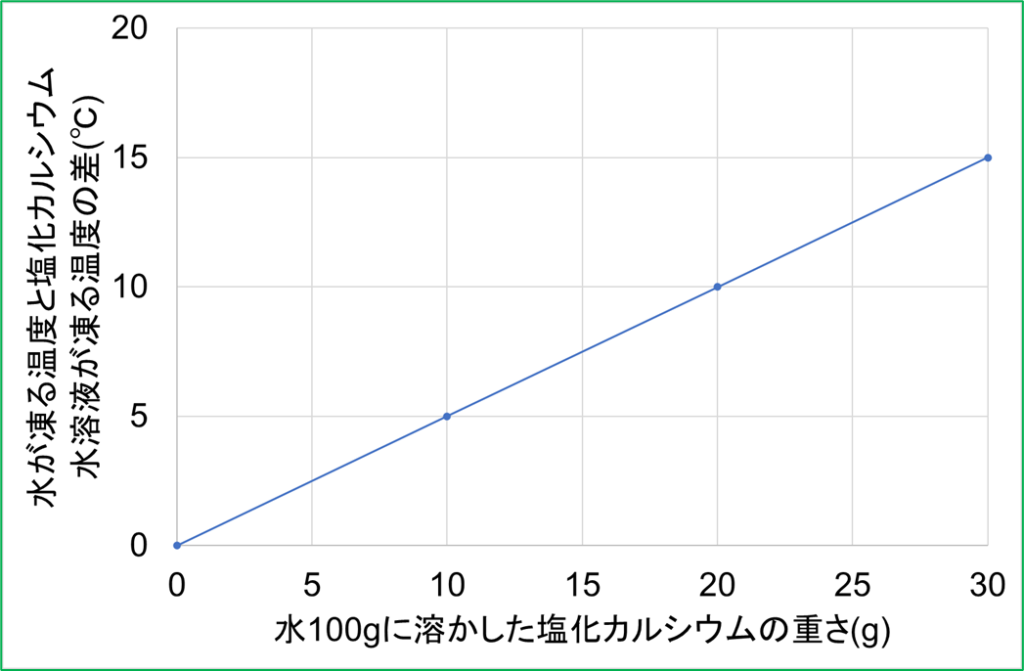
グラフを見ると,塩化カルシウムを6g溶かすと,凝固点が-3℃になっていることから,水100gに塩化カルシウムを1g溶かすにつれて-0.5℃ずつ凝固点が下がっていくことが分かります。
つまり,水100gに塩化カルシウムを10g溶かすと,凝固点はマイナス5℃になることが分かります。
(5)
(4)より,水100gに塩化カルシウムを1g溶かすにつれて-0.5℃ずつ凝固点が下がるので,7.8÷0.5=15.6より,溶かした塩化カルシウムの重さは15.6gとなります。
(6)
水100gに塩化カルシウムを1g溶かすにつれて-0.5℃ずつ凝固点が下がるということをグラフに表しましょう。
(7)
それぞれの場合について,凝固点が-10℃より低くなっているかを調べましょう。
- ア:凝固点マイナス3℃
- イ:グラフより,凝固点はマイナス3℃より高い。
- ウ:水100gあたりに直すと24g溶けていることになるので,グラフより,凝固点はマイナス9℃より高い。
- エ:水100gあたりに直すと24g溶けていることになるので,凝固点マイナス12℃
よって正解はエとなります。
まとめ
水の沸点は100℃で凝固点は0℃ですが,水溶液となったり外の圧力が変化することでその温度は変化します。融雪剤と共に問題のテーマとして取り上げられることがあるので,ぜひ覚えておきましょう。
もっと詳しく知りたい人は高校化学の教科書などを参考にしてみてください!


















