何かの漫画やアニメなどで,化学実験をしているときに「薬品を混ぜたら爆発」なんてシーンを見たことがある人も多いでしょう. 混ぜる順番を間違えたら爆発した,なんて場面を見たこともあるかもしれません. ここで,結局同じものを混ぜているのだから順番なんていいじゃないか,と思ったことがある人もいるのではないでしょうか. 私も以前はそう思っていました.しかし実際には,実験では混ぜる順番が重要になってくることもあるのです. その原因の1つに「 反応熱 」と呼ばれるものがあります. ここでは化学反応のときに発生する「反応熱」について,身近な例も交えながら紹介していきます.

Contents
反応熱
みなさんは物質が反応しているときに熱を出したり吸収しているのを知っていますか?
実際に実験していないから分からなかったり,小学校で扱うような実験では熱が出ていたとしてもほとんど体で感じることができないくらいのものであることも多いため,なかなか実感が持てない方も多いと思います.
しかし実際に反応が起こっているフラスコを手で触ってみたりすると熱かったり,冷たかったりする場合があります.
これは物質が反応中に外に熱を放出したり,逆に外から熱を吸収しているからです.
このように,物質が反応しているときに放出したり吸収したりする熱のことを,「反応熱」と呼びます.
反応熱は物が反応しているとき,すなわち燃えてるときや水に溶けるとき,中和が起こっているとき,蒸発したり融解しているときなどに発生します.
発熱反応と吸熱反応
化学反応は反応熱に注目したとき,次の2種類に分類することができます.
化学反応を起こしたとき,その物質が周りに熱エネルギーを放出して,周囲の温度が上昇するようなものを「発熱反応」といいます.
化学反応を起こしたとき,その物質が周りから熱エネルギーを吸収して,周囲の温度が下がるようなものを「吸熱反応」といいます.
言葉だけでは分かりにくいと思うので,次に身近なものも含めて発熱反応と吸熱反応の例を紹介します.
発熱反応
まず身近なものですが,カイロです.
カイロの中には鉄の粉が入っているのですが,袋を開けてカイロを振ることで,中の鉄の粉が空気中の酸素と触れて酸化反応を起こします.
この反応はゆっくりですが,周りに熱を出すようにして反応が進みます.
私たちが暖かいと感じている熱は,カイロの中で鉄の酸化という発熱反応が起きているからなのです.
酸化反応と言えばものを燃やす,いわゆる「燃焼」も発熱反応です.
ここで生じる熱エネルギーは非常に大きなものとなります.
他にも水が水蒸気→水→氷となるときも周りに熱を出しています
さらに水に水酸化ナトリウムを溶かしたときなども熱を発生し,実際に水酸化ナトリウムが溶けきるまでは水溶液の温度が上昇しています.
吸熱反応
まず身近なものを挙げると,アルコール(エタノール)消毒です.
みなさんはエタノールで手を消毒したあと,スース―してひんやりするのが印象に残っていることでしょう.
あれはエタノールが気体へと蒸発するときに周りから熱を吸収しているからです.
私たちにとっては熱を奪われているので,冷たく感じるのです.
次に水酸化バリウムに塩化アンモニウムを加えたときにアンモニアが発生する化学反応です.
これは吸熱反応で,温度計で温度を測りながら反応を起こすと,実際に温度が下がっていく様子を観測することができます.
反応熱 の危険な例
さて,この記事の最初の話題に戻ってみましょう.
化学実験で薬品を混ぜる順番についてです.
ここでは硫酸の例を紹介しましょう.
硫酸を薄めるとき,水と硫酸を混ぜることで硫酸の濃度を薄めることができます.
さて,皆さんはここで水に硫酸を少しずつ入れますか?
それとも硫酸に水を入れますか?
この2つは大きな違いがあります.
硫酸が水に溶けるときの反応熱はとても大きなものです.
ここで硫酸に水を入れるという操作を行ってしまうと,少量であれば爆発こそしませんが,大きな熱が発生することで硫酸や水が沸騰し,しぶきが跳ねます.
硫酸のしぶきが体にかかると溶けてしまい,悲惨なことになるので非常に危険です.
発生する熱をできるだけ抑えながら反応を進めるため,水に少しずつ濃硫酸を入れる方が好ましいのです.
また化学反応の中には少しの熱ですぐに進んでしまうものもあります. 例えばこれが発熱反応だったりすると,反応で発生した熱そのものがまた次の反応を起こすことがあります.
この反応の連鎖があまりにも早すぎるときに爆発が起こるのです.
このように実験の際には,物質を反応させたときに生じる熱に気を付けながら,慎重に操作を行う必要があるのです.
入試実践演習 反応熱
ここまでに学習したことを活かして実際の入試問題に挑戦してみましょう.
問題

解答
問1
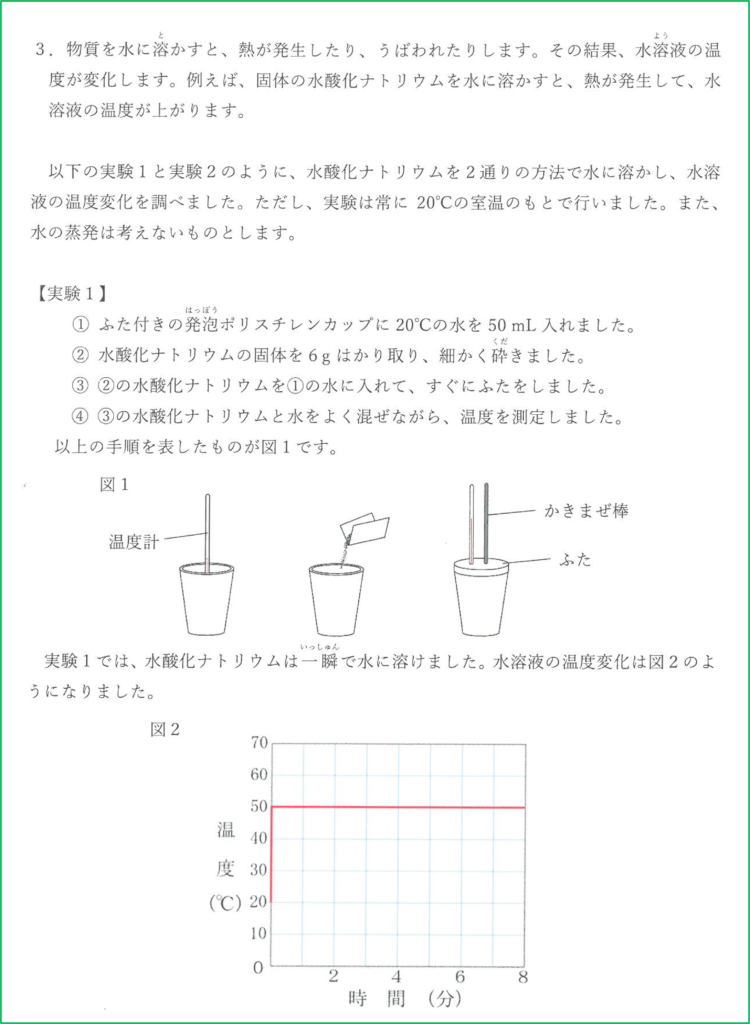
(1) 水酸化ナトリウムは粒状固体なので,水に完全に溶けきるまでに時間がかかるから。
(2) 溶けることによる熱の発生が止まって,熱が周りの空気中へ逃げていくため。
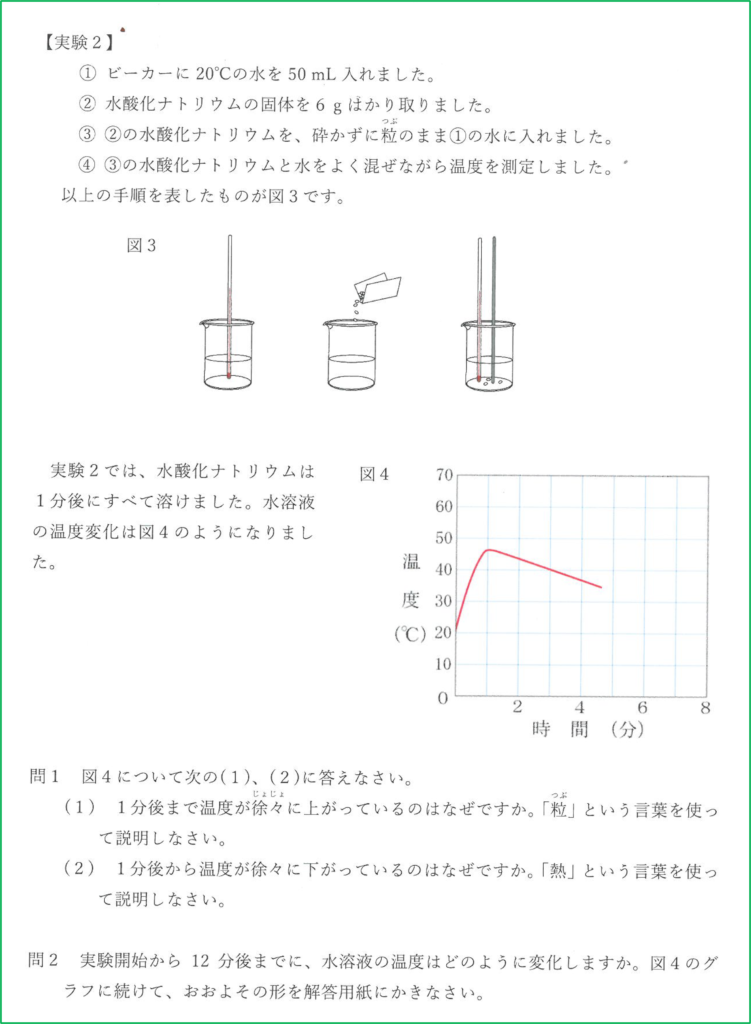
問2
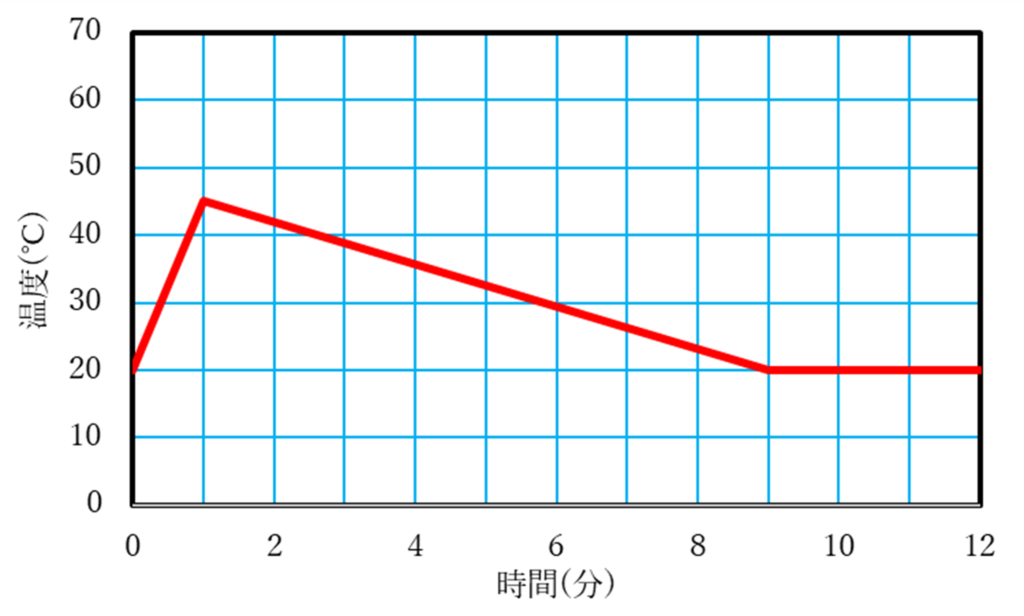
問3 50 ℃
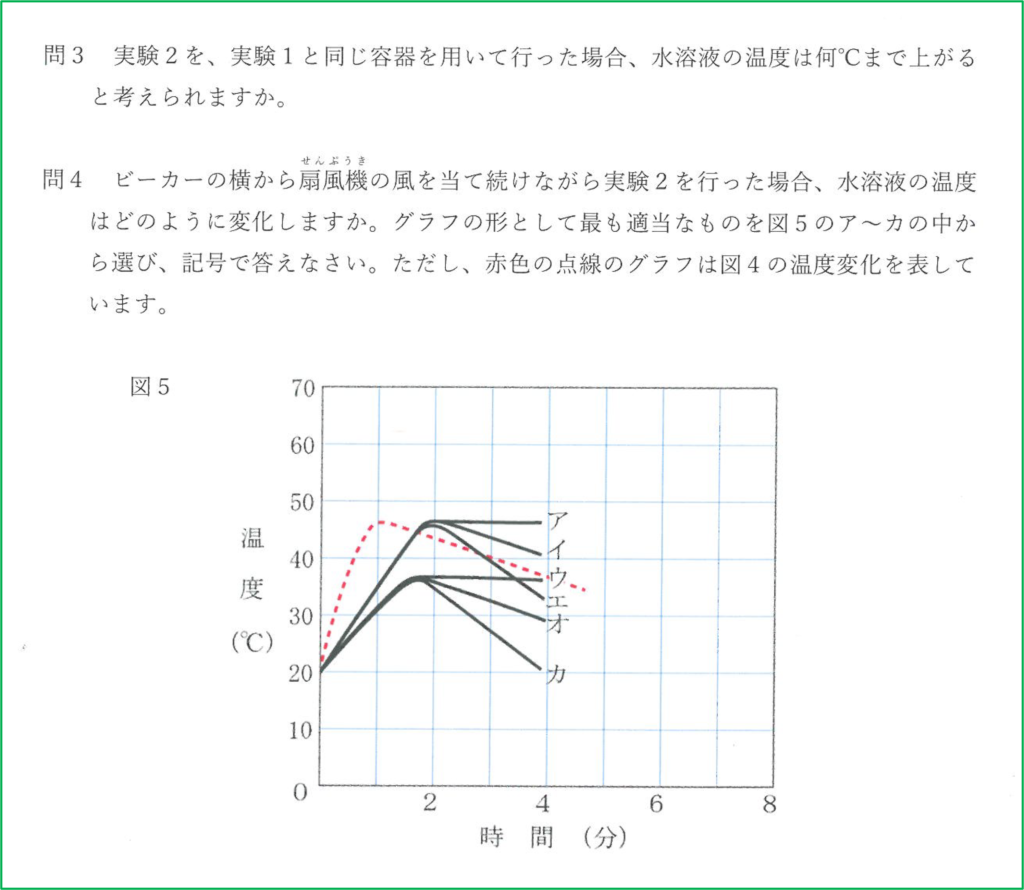
問4 カ
問5
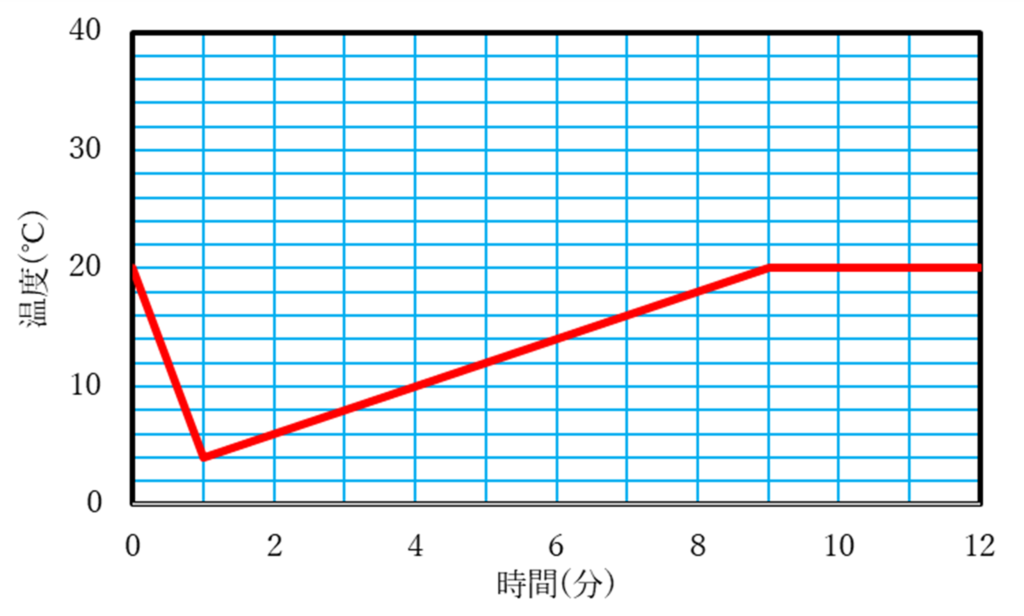
問6 2 ℃
解説
問1
解答の通り
問2
室温である20℃まで下がったら,水溶液の温度と空気の温度が同じになるため,そこで熱のやりとりは止まり,20℃をキープします.
問3
ポリスチレンカップ内で実験を行うと,熱が外に逃げていかなくなるため,発生した熱が逃げずに水の温度を上昇させます.
今,実験1と水の量や水酸化ナトリウムの固体の重さは同じなので,溶けるまでの時間はかかっても発生する熱が同じであることとそれが逃げないことから,実験1と同じ50℃まで上昇すると考えられます.
問4
扇風機で冷たい空気を送り続けると熱が奪われるのが早くなります.
水酸化ナトリウムが溶けているとき,熱の発生も起こっていますが,同時に熱が外へ逃げていく過程も起こっているので温度の最大値は赤い点線のものよりも小さくなります.
また,溶け終わった後も熱が奪われるのは早いので冷めるのも早くなります.
よって最大値が赤線より低く,温度が下がっているときの下がり方が急な「カ」が正解です.
問5
3分で8℃,5分で12℃,8分で18℃のところに点をうちます. これを結ぶと直線になります.
この直線を1分のところまで伸ばし,1分のところから,0分時点で室温の20℃になるように直線を引きます(実際には直線ではありませんがここでは概形なので直線で良い).
8分以降は20℃のところまで伸ばし,それ以降は問2と同じように20℃がキープされる.
問6
熱の出入りがない場合,問5で最初に引いた直線を0分の所までのばしたときの温度が,熱が逃げないときの最大の温度になる
まとめ……の前に
登録6000人以上!
本サイト、中学受験ナビの監修も務めている『開成番長』こと繁田和貴が執筆する完全無料のメールマガジンでは、主に中学受験生のお子さんをお持ちの方へ向けた様々なお役立ち情報を配信中!
さらに今なら登録者にはもれなく「開成番長・繁田監修 中学受験必勝の5箇条PDF」をプレゼント!
登録及び登録解除も簡単ですので、お気軽にご登録ください。

まとめ
反応のときに熱が発生することはなかなか実感がわかないかもしれませんが,実際には実験計画を立てる際などに重要になります. 身の回りの物質の変化は熱のやりとりを伴うことを意識しながら,身の回りの発熱反応や吸熱反応を探してみることでより感覚が身に付くかもしれません. 熱の分野ととも絡むことが多いので復習しておきましょう.