Contents
(1) 原子の構造
原子…物質を構成している最小単位の粒。どのような物質も原子が集まってできている。
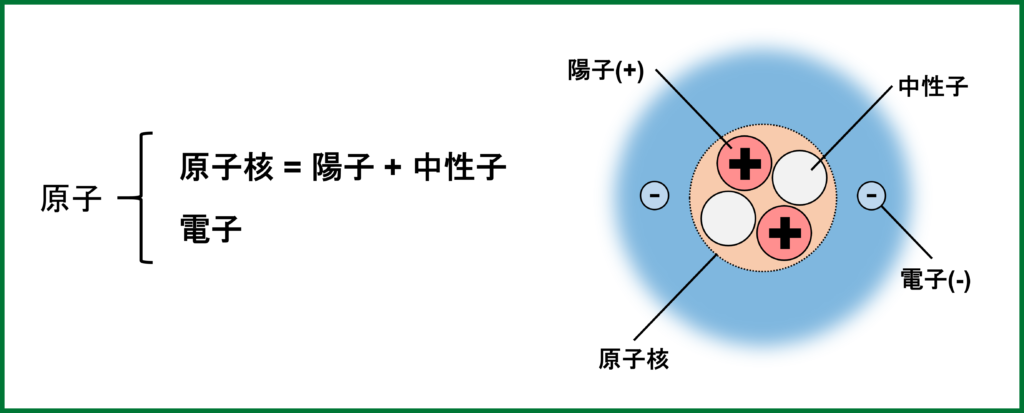
原子の中心には+の電荷を帯びた原子核があり、その周りを-の電荷を帯びた電子が存在している。(原子全体で±0)
また、原子核は+の電荷を持つ陽子と電荷がなく±0の中性子から成る。
(2) 原子番号と質量数
原子は全体で電荷が±0になるため、+の陽子の数=−の電子の数となる。
→この数を原子番号として、原子の区別をする目安となる。
→電子の重さは、陽子や中性子の約1/1840であり、とても軽い。
ゆえに原子の重さは、陽子と中性子の合計とほとんど同じであり、これを質量数という。

元素(原子の種類)を表記する際は、正式には質量数と原子番号を左に書くことになっている。ただし、省略されることが多い。

(3) 周期表の基本
元素というのは原子の種類である。この元素は118種類知られている(2019年現在)。これを原子番号の順に並べたものを周期表という。元々は原子量順であった。考案者はメンデレーエフである。
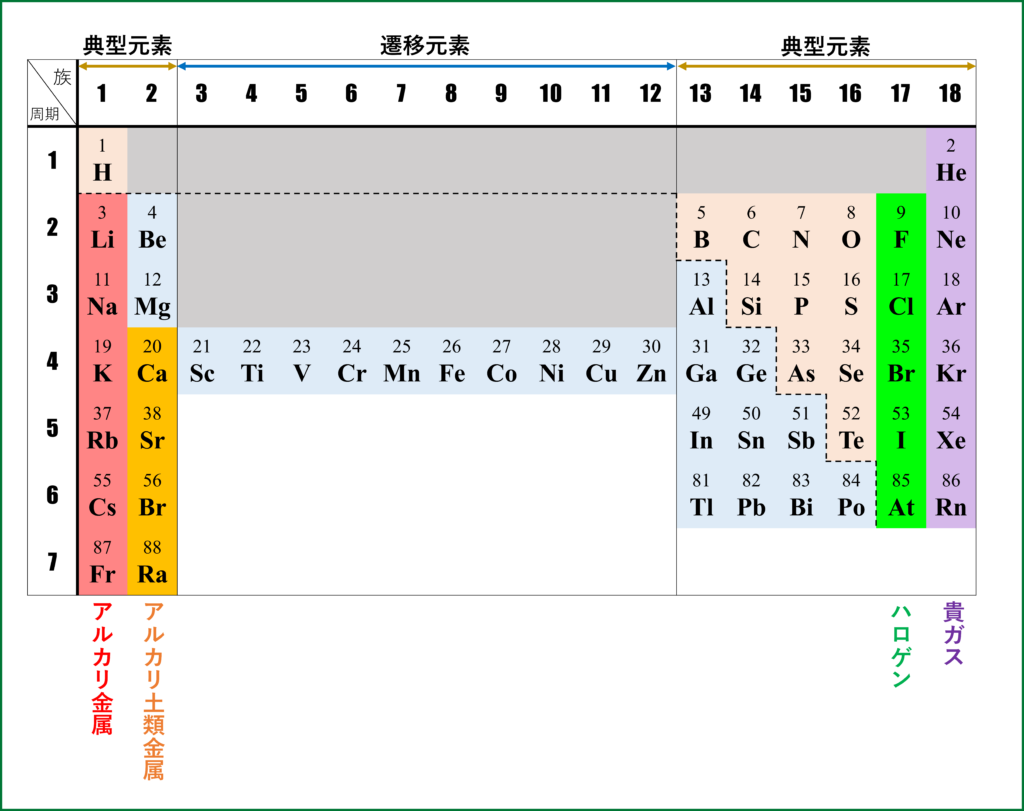
周期表の横の行1~7の繰り返しを周期、縦の列1~18を族という。周期表の点線で引かれた部分より左下の元素は金属の性質を示すので金属元素という。それ以外の右の元素を非金属元素という。
1,2族および12~18族は一定の酸化数をとる典型元素であり、3~11族を同一元素でも異なる酸化数を持つ遷移元素という(詳しくは酸化数についての分野で後述)。
周期表の薄い赤色部分のH以外の1族はアルカリ金属と呼ばれ、周期表の薄い橙色部分のBe,Mg以外の2族はアルカリ土類金属と呼ばれる。また、17族はハロゲン、18族は貴ガスと呼ばれる。
◎語呂合わせ
1~20番 … 水兵リーベ僕の船。七曲りシップスクラークか?
21~30番 … スコッチ暴露マン、徹子にどうしても会えん
1族 … Hでリッチな母ちゃんがルビーせしめにフランスへ
2族 … 勉強まじめかすばらしい/ベッドに潜ればカスばかり
13族 … 僕にもあるがなインテリジェンス
14族 … くさい下痢がすんなり治った
15族 … 日本の明日はすばらしい
16族 … 大阪製鉄砲
17族 … ふっくらブラウス私にあてて
18族 … へーい姉ちゃん、俺の車くせぇだろう
(4) 同位体
(1)でみたように中性子は電荷を持たないので、陽子や電子と違って個数にあまり制限がない。そのため、同じ元素であっても中性子の数が異なる。よって質量数のみが異なるものが存在することがある。そのようなものを互いに同位体という。これらの化学的性質は同じである。

また、同位体の中でも時間が経つと放射線を放出して他の原子へと変わってしまうものがある。これを放射性同位体という。

(5) 電子殻と電子配置
(2)でみたように、周期表は原子番号=陽子の数=電子の数という順に並んでいる。つまりHは電子1個、Heは電子2個、Liは電子3個と原子核の周りを周っている。ここではそれらがどのように周っているのかを見ていく。
電気的に+のものと-ののもが引かれ合う力のことをクーロン力という。電子は-の電荷を帯びているため、クーロン力により、できるだけ+の電荷を帯びている原子核の近くを周りたい。しかし、-の電子同士は互いに反発しあうため、実際は何層にも分かれて周っている。この層のことを電子殻といい、内側からK殻、L殻、M殻、N殻…と呼ばれている。電子は内側から順に入っていくため、K殻から順に入っている。
また、それぞれの殻には電子が何個まで入れるかという上限があり、内側からn番目の殻の上限は 2n2となっている。つまりK殻は2個、L殻は8個、M殻は18個、N殻は32個…と続いていく。
しかし、KとCaは例外である。一般的に殻に電子が8個入ると安定するため、上限まで電子が入らなくても次の殻に電子が入り始める。
Ex1) Bの電子配置→Bは電子5個なので、K殻に2個、L殻に3個
Ex2) Alの電子配置→Alは電子13個なので、K殻に2個、L殻に8個、M殻に3個
Ex3) Kの電子配置→Kは電子19個なので、K殻に2個、L殻に8個、
M殻に8個(上限は18だが、8個で一度安定するため)、N殻に1個
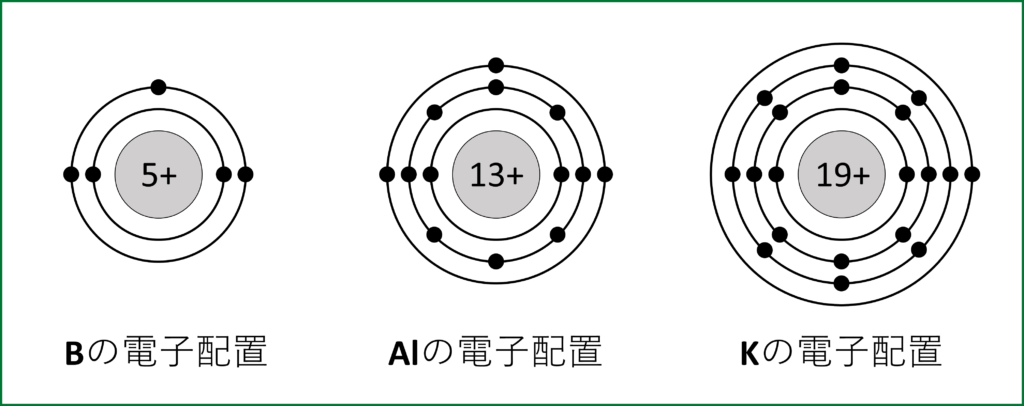
ここで、最も外側の殻のことを最外殻という。Bの最外殻電子数は3個、Alの最外殻電子数も3個、Kの最外殻電子数は1個である。基本的に反応に関与するのは一番外側の電子なので、このような名称がついている。
上の図より、原子の最外殻電子数は周期表の族番号の下一桁と一致する(典型元素のみ)。この最外殻の電子は反応に大きく関与するので、見る価値のある電子ということから価電子という。基本的には最外殻電子数=価電子数だが、18族の希ガスに関しては最外殻が8個で安定しており反応しないため、価電子数を0とみなす。
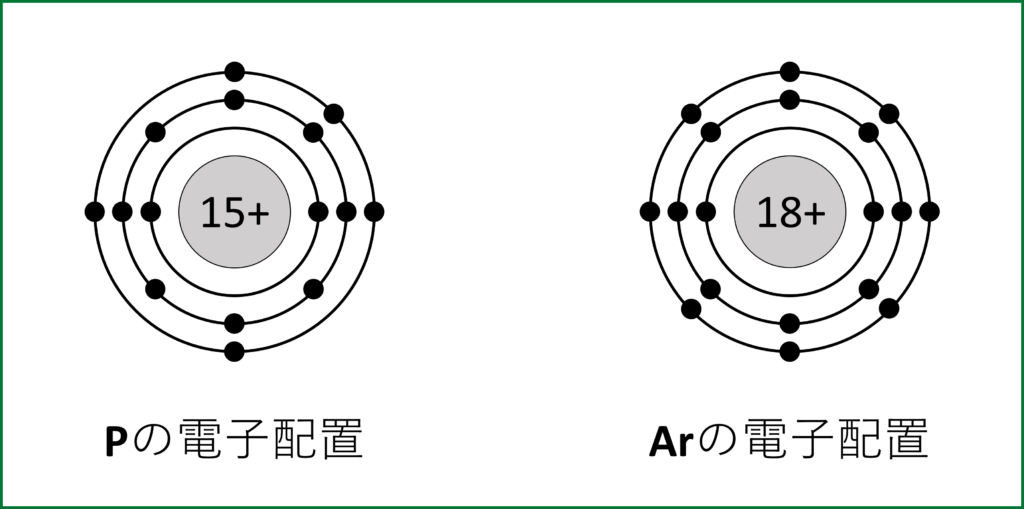
Ex4) Pは15族なので最外殻電子数=価電子数=5である。
原子番号15なのでK殻に2個、L殻に8個、M殻に5個の電子が入る。
Ex5) Arは18族なので最外殻電子数=8、価電子数=0である。
K殻に2個、L殻に8個、M殻に8個の電子が入る。
(6) 陽イオンと陰イオン
⑸では18族のように殻に電子が8コ入った状態が安定だということを述べた。このような電子配置を閉殻構造または貴ガス型電子配置といい、全ての原子はこの安定な貴ガス型電子配置を理想とし、目指している。
その結果、余った電子を放出したり、足りない電子をもらって希ガス型になろうとする。これがイオンである。
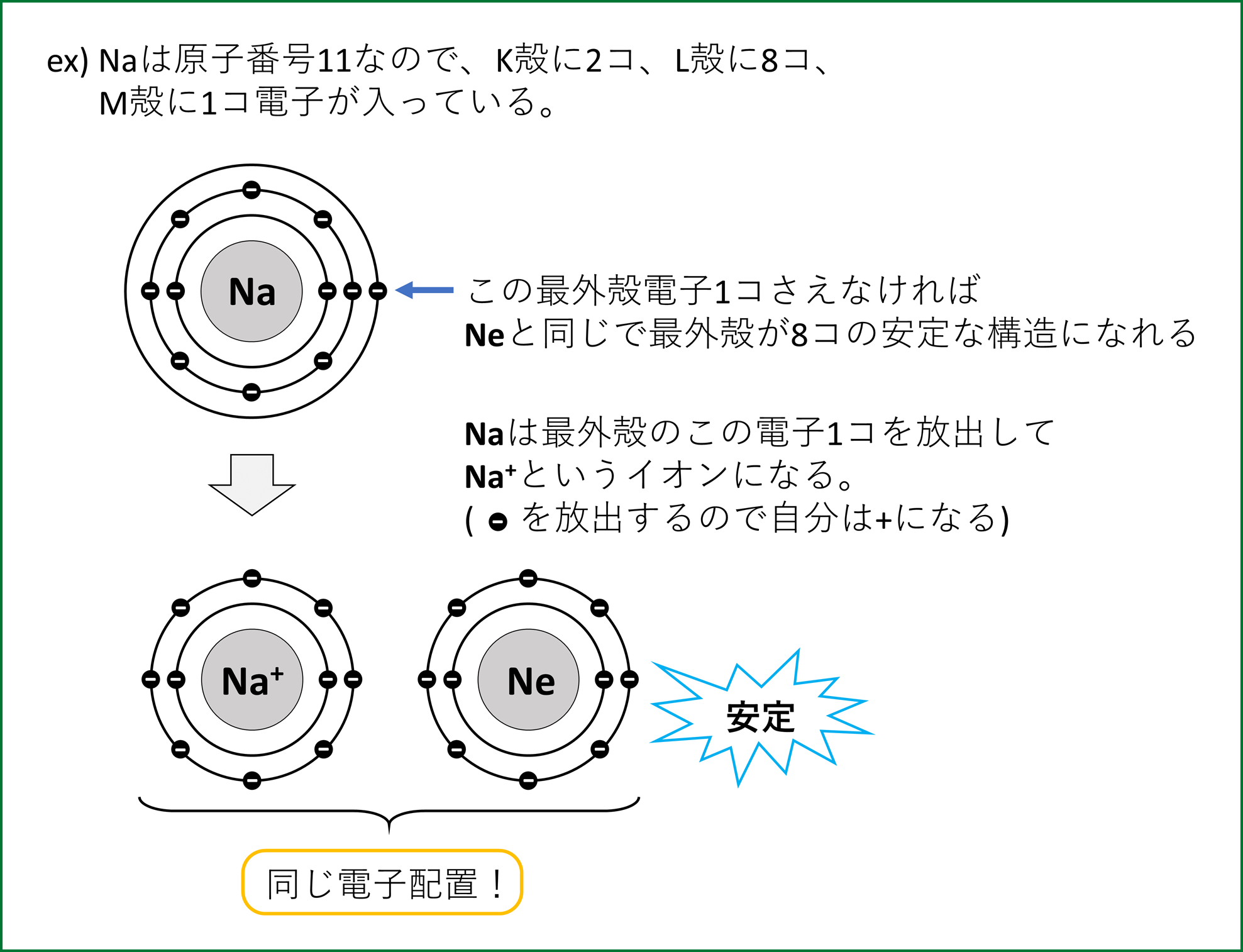
このように余った電子を放出して貴ガス型の安定な配置になったものを陽イオンという。
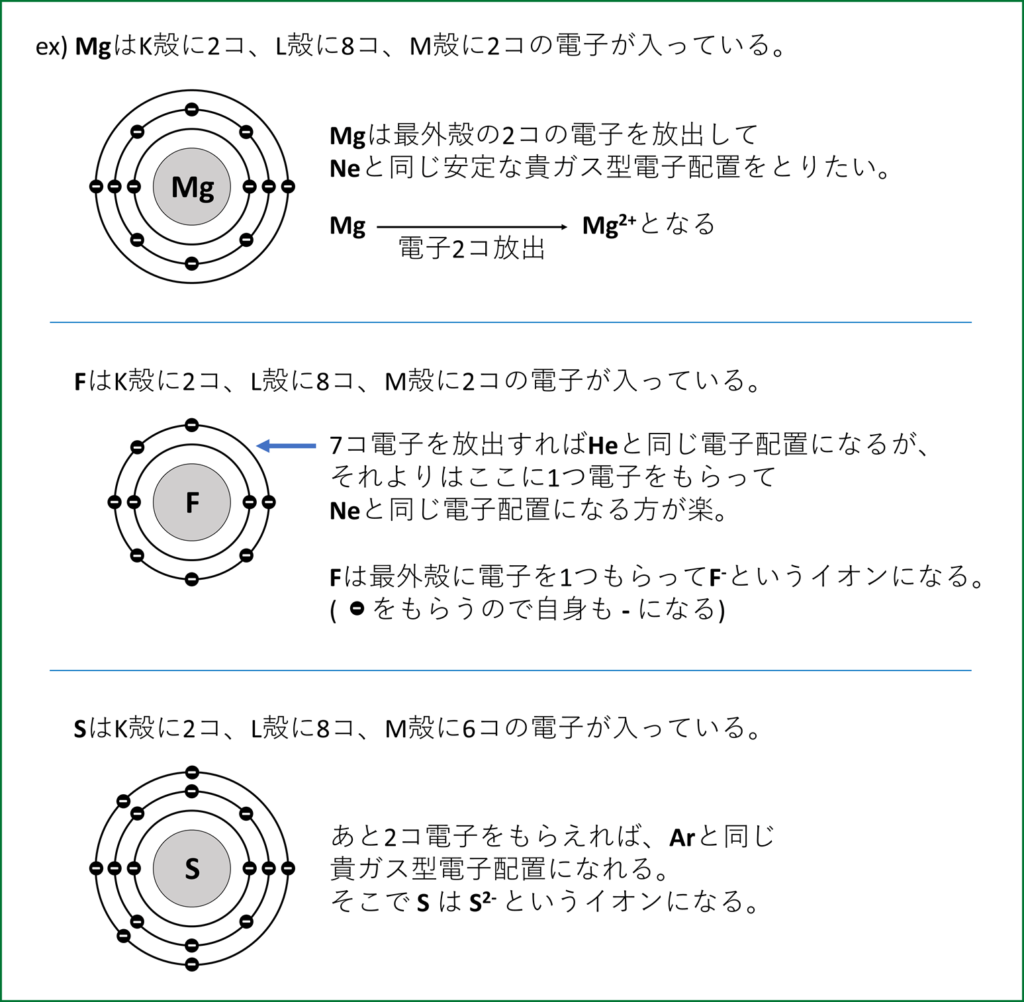
このように、足りない電子をもらって希ガス型の安定な電子配置になったものを陰イオンという。
※F–、S2-、Na+、Mg2+のように右上に書いている+や−と数字をイオン価数という。
F–、Na+のように1つの原子が電子をもらったり、あげたりしてイオンになっているもの(単原子イオン)もいるが、SO42-といったように複数の原子が集まってイオンになっているもの(多原子イオン)もいる。単原子イオンは最外殻電子とにらめっこすればイオンが分かるものが多いが、多原子イオンは代表的なものは必ず覚えること。

(7) イオンと周期律
この⑺節ではまず、イオン化エネルギーと電子親和力という『原子がどのくらいイオンになりやすいか』を表す言葉を紹介する。
ⅰ) イオン化エネルギー
ある原子から1つ電子を取り去るのに必要なエネルギー。イオン化エネルギーが大きいということは電子をある原子から取り去るのがとても大変(エネルギーがたくさん必要)ということを意味する。
ex) Naは最外殻電子が1つで、その1つを放出してNa+になりたいので、
とてもイオン化エネルギーは小さい。
ex) 希ガス原子は最外殻電子が8つで、ちょうど安定なので
1つも電子を放出したくなく、イオン化エネルギーはとても大きい。
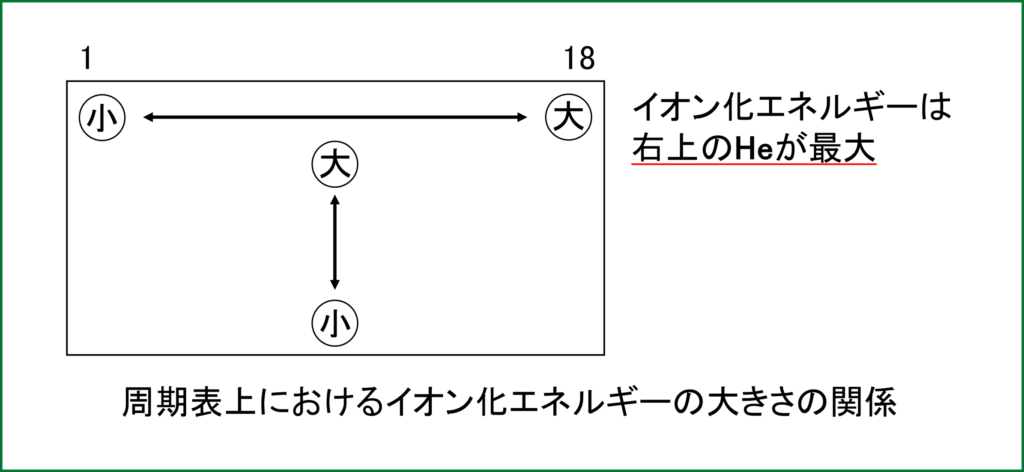
この2つの例から分かるように、イオン化エネルギーは周期表の右へ行くほど大きくなる。(最外殻電子が1つ、2つなら放出したがるが、5つ、6つ…と増えていくと放出するより受け取って陰イオンになりたくなってくる。)
★発展
原子核の+と最外殻電子の−とのクーロン力による結びつきが強ければ強いほど電子を取り去りにくくなり、イオン化エネルギーが大きくなる。そのため、周期表の下へ行けば行くほど、最外殻電子と中心の原子核が離れていくため、クーロン力は弱くなり、電子を取り去りやすくなる。つまり、周期表は下へ行くとイオン化エネルギーは小さくなっていく。
ⅱ) 電子親和力
ある原子に電子に1つ与えた時に、どのくらい安定化するか、というエネルギーの値。電子親和力が大きいということは、電子を1つ受け取るととても安定になるということを意味する。
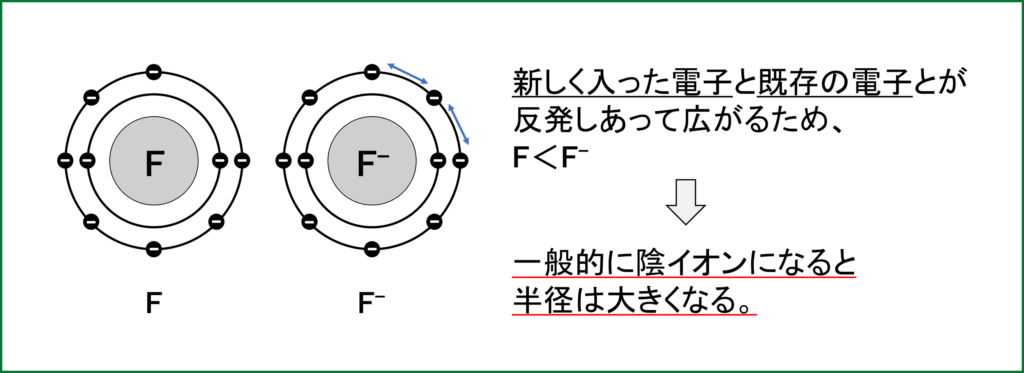
ex) Fは最外殻電子が7つなので、あと1つ電子をもらってF–になって
安定な希ガス配置になりたい。そのためFは電子親和力が大きい。
ex) Naは最外殻電子が1つなので電子を1つもらってもいらない、
どころかむしろ電子を放出したい。そのため、Naは電子親和力は小さい。
これらから見て分かる通り、電子親和力も周期表の右へ(上へ)行くほど大きくなる。(ただし貴ガスは除く。貴ガスは考えないのが通例。)
このように、周期表では規則正しく、似た性質を持つ元素が周期的に表れる。これを周期律という。特に縦に周期表を見ると似たものが多い。
ⅲ) イオン半径
イオンの大きさも実は周期的に変化していく!
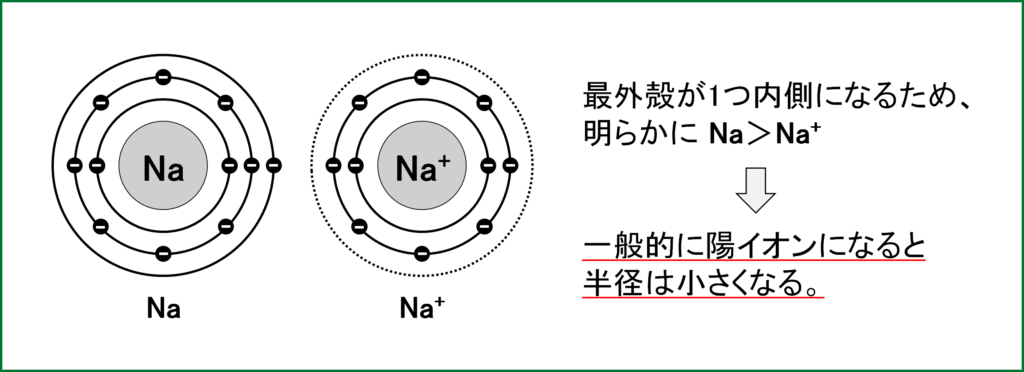
ここではまず、NaとNa+、FとF–のイオン半径を比べてみる。
① NaとNa+
② FとF–
③ Na+とF–(どちらもNe型電子配置)
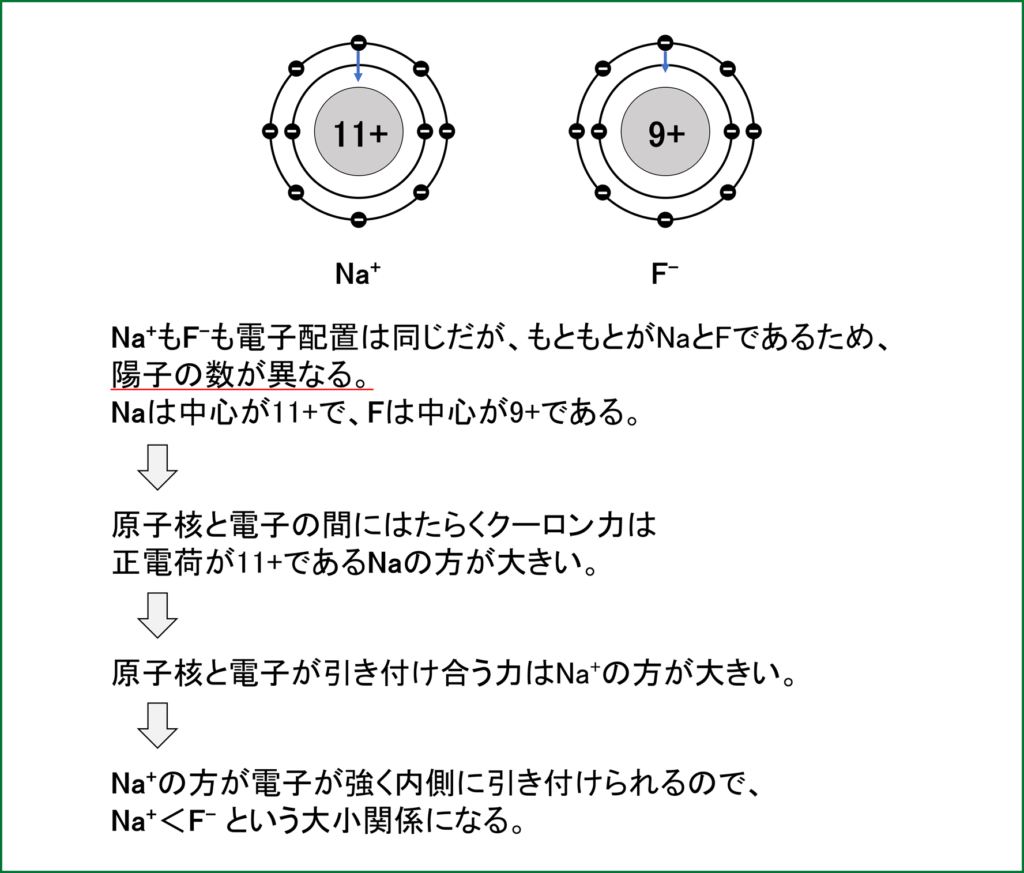

ex) Mg2+、O2-、Na+、Al3+、F–、NeはどれもNe型の電子配置だが、陽子の数を考えると
Al3+>Mg2+>Na+>Ne> F–>O2-の順にクーロン力は強くはたらくため、
イオン半径は、O2->F–>Ne>Na+>Mg2+>Al3+>となる。
★ここまでは原子1つ1つについて細かく見てきたが、実際にはH2O(水)などがよく知られているように、原子と原子はくっついて存在しているものが多い。このように、原子がいくつか集まって1つのグループを作ったものを分子という。また、原子と原子がくっつくことを結合するという。この結合は以下の3つのパターンがある。
① イオン結合 … 金属元素と非金属元素の結合
② 共有結合 … 非金属元素と非金属元素の結合
③ 金属結合 … 金属元素と金属元素の結合