Contents
エネルギー保存と反応熱
物質はどれもそれぞれ固有のエネルギーを持っているエネルギー保存と反応熱。
それは、たとえばその物質を構成する原子同士の引力によるものであったり、原子の熱運動による運動エネルギーであったりと様々な要素に起因している。
そのため、ある化学反応が起きた時に、もともとの反応物と生成物ではエネルギーが異なる。
しかし、エネルギーは保存則が成り立っており、反応によりエネルギーが勝手に増えたり減ったりすることはない。
実際、反応物と生成物でのエネルギーの差は、反応に伴う熱や光の吸収・放出によりエネルギーとして帳尻を合わせている。
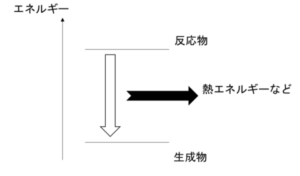
図1
ここで、図1のように反応物のエネルギーが生成物のエネルギーより大きいために、反応に伴ってエネルギーを放出するものを発熱反応という。
その反対に、反応に伴ってエネルギーを吸収するものを吸熱反応という。
そして、これらの吸収・放出されるエネルギー差のことを反応熱という。
※一般にエネルギーは低い方が安定である。
熱化学方程式
CH4(メタン)が燃焼する化学反応について考えてみる。
まず、化学反応式は
CH4 + 2O2 → CO2 + 2H2O
である。
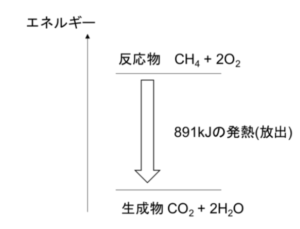
図2
燃焼する際には発熱を伴うので、⑴のようなエネルギー図としては図2のようになる、発熱反応である。
反応熱はkJ単位で表され、今回は891kJである。
これら2つの要素を融合させた、反応物と生成物に関するエネルギー等式のことを、熱化学方程式といい、下に示すようなものである。
CH4(気) + 2O2(気) = CO2(気) + 2H2O(液) + 891kJ
特徴としては、
- 発熱反応なら+、吸熱反応なら-で右辺に反応熱を書く。
Ex) N2(気) + O2(気) = 2NO(気) – 181kJという吸熱反応は直感的にわかりにくいが、数学的に反応熱を左辺に移行して、
N2(気) + O2(気) + 181kJ = 2NO(気)
とすると、N2とO2を混合し、さらに181kJ熱を加えて、ようやく2NOが生成するという意味になり、吸熱と分かりやすい。 - 物質が持つ固有のエネルギーは、それが気体状態か液体状態か固体状態なのかで変わるため、必ず状態を1つ1つ( )で書く。
なお、気体はgasよりg、液体はliquidよりl、固体はsolidよりsと以下略していく。
また、Cのように同素体が存在するものは(黒鉛)、(ダイヤモンド)のように表記する。 - 反応熱は物質1molあたりで定義されるため、上でいえばCH4のように代表物質は必ず係数を1とする。
そのため、他の係数が分数になってもよい。 - 反応式では左と右を→で結ぶが、熱化学方程式では=で結ぶ。
反応熱の種類
反応によって反応熱に名前が付いている。発熱か吸熱かは自分で考えられる。
- 燃焼熱 : ある物質1molが燃焼する時の反応熱
Ex) CH3OH(l) + \(\frac{3}{2}\)O2(g) = CO2(g) + 2H20(l) + 726kJ
CH3OHの燃焼熱 - 生成熱 : ある物質1molがその構成元素の単体から生成する時の反応熱
Ex) NH3の生成熱は46kJであるとすると、
\(\frac{1}{2}\)N2(g) + \(\frac{3}{2}\)H2(g) = NH3(g) + 46kJ
ここの係数を1とする
Ex2) CO2(g)の生成熱は394kJ/molとすると、
C(黒鉛) + O2(g) = CO2(g) + 394kJ - 溶解熱 : ある物質1molが溶媒に溶解する時の反応熱
Ex) H2SO4(l) + aq = H2SO4aq + 95kJ
H2SO4の溶解熱 - 蒸発熱 : ある物質1molが蒸発する時の反応熱
Ex) H2O(l)の蒸発熱は44kJ/molである。
H2O(l) = H2O(g) – 44kJ
これは吸熱である。左辺に移行すると、液体の水に熱を44kJを加えて気体にする、となって分かりやすい。
※融解熱、昇華熱、凝固熱…etcも同様。
ヘスの法則
反応熱に関する大変重要な法則。
〈ヘスの法則〉
物質が変化する際の反応熱の大きさは、
変化する前と変化した後の状態のみによって決まり、反応経路によらない。
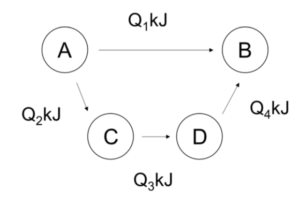
図3
反応物Aから生成物B が発生する反応のとき、
Aから直接Bを作ろうと、C・Dを経由してBをつくっても反応熱は等しい。
∴ Q1 = Q2 + Q3 + Q4
- Ex) 固体の水酸化ナトリウムを塩酸で中和する反応には2つの経路が考えられる。
①直接この2つを混ぜる。
NaOH(s) + HClaq = NaClaq + H2O(l) + 101kJ
②NaOHを水に溶かしてから塩酸を混ぜる。
NaOH(s) + aq = NaOHaq + 44.5kJ
HClaq + NaOHaq = NaClaq + H2O(l) + 56.5kJ
→結局反応熱は101kJ
熱化学方程式の問題の解法
ヘスの法則を用いると、直接測定や厳しい反応熱を計算により求めることができる。
たとえば以下のような問題があるとする。
問い.メタン(CH4)の燃焼熱を求めよ。
ただし、気体のCO2、液体のH2O、気体のCH4の生成熱はそれぞれ、394kJ/mol、286kJ/mol、75kJ/molとする。
〈解法①〉熱化学方程式を連立する。~最も確実~
C(黒鉛) + O2(g) = CO2(g) + 394kJ …(a)
H2(g) +\(\frac{1}{2}\)O2(g) = H2O(l) + 286kJ …(b)
C(黒鉛) + 2H2(g) = CH4(g) + 75kJ …(c)
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) + □kJ …(d)
(a)(b)(c)の3式から(d)を導いて□kJを求めていく。
まず(d)に近づけようと、C(黒鉛)を消すために(a)-(c)をしてみる。
O2(g) – 2H2(g) = CO2(g) – CH4(g) + 319kJ
整理して
CH4(g) + O2(g) = CO2(g) + 2H2(g) + 319kJ
ここに
2H2(g) + O2(g) = 2H20(l) + 572kJ …2×(b)
を足して、
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) + 891kJ …(d)
となるので、891kJ
〈解法②〉エネルギー図を書く。~書くのは難しいけど分かりやすい~
今回登場するのはCO2、H2O、CH4の3つであり、さらにC、H2、O2の全てが単体である状態が最もエネルギーが高いことを考えて、エネルギー図を書く。
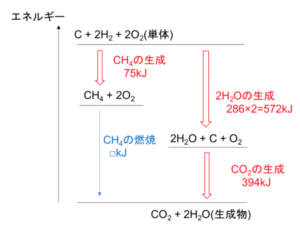
図4
図4より
∴ □ = 572 + 394 – 75
= 891kJ
〈解法③〉単体を消去する。~オススメ。使う際に注意がいるが最速~
物質はO2(g)のような単体だろうがCO2(g)のような化合物だろうが、もちろん固有のエネルギーを持つが、ここでは単体の持つエネルギーを0とした時の相対的なエネルギーを考えていく。
その世界では単体のもつエネルギーは0なので単体はないものとして考えられる!

式1
(a)、(b)、(c)より各化合物の持つ相対的なエネルギーが求まったので、(d)に代入し、
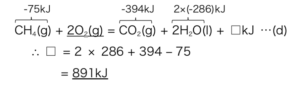
式2
とても早く簡単に解くことが出来るが、1点注意点がある。
単体を0としているため、単体状態が最もエネルギーの高い最小単位である時にしか使えない。
後述する(b)の結合エネルギーのような、より最小単位がでてきた時は、そちらを0として基準に消去していく。
Ex) CO2(g)、H2O(l)の生成熱は、それぞれ394kJ/mol、286kJ/molである。
またプロパンC3H8の燃焼熱は2220kJ/molである。プロパンの生成熱は?

式3
結合エネルギー
結合エネルギーとは
分子内の結合を切って原子同士を引き離すのに必要なエネルギーを結合エネルギーという。
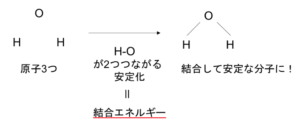
図5
- Ex) H2(l) = 2H(l) – 432kJ
-432kJ 結合エネルギー
これは移行するすると、H2(l) + 432kJ = 2H(l)となって、安定な分子H2に432kJの熱を加えることでHとHを引き離せるという直観的に分かりやすい結合エネルギーとなる。
ただし問題を解く際には、今度は単体を0とは出来ない!
単体より1ステップ下の原子状態を0とすれば同様にして解くことができる。
★発展
※大学以降ないしは近々高校科学では反応熱という概念は使わなくなる。
反応熱に対応する概念としてエンタルピーを用いる。
定圧条件下では、正負が入れ替わるだけでほぼ同じものを指し、熱エネルギー変化のエンタルピーと乱雑さのエントロピーの2つから、反応が自発的に進むかどうかを判断できる。
練習問題
- NH3(g)の生成熱を求めよ。ただし、N≡N、H-H、N-Hの結合エネルギーをそれぞれ945kJ/mol、436kJ/mol、391kJ/molとする。
- H2O(l)、CO2(g)、CH4(g)の生成熱はそれぞれ286kJ/mol、394kJ/mol、74kJ/molとする。
また、炭素の昇華エネルギーを718kJ/mol、H-H結合エネルギーを436kJ/mol、C-C結合エネルギーを331kJ/molとする。(2005 広島大改)
⑴メタン(CH4)の燃焼熱は?
⑵メタンのC-H結合エネルギーを求めよ。
⑶エタン(C2H6)の結合エネルギーの総和を求めよ。
【解法】

式4
⑴燃焼熱は生成熱のみから導かれるので単体を消去できる。

式5
⑵結合エネルギーが絡むので単体を消去してはいけない。

式6
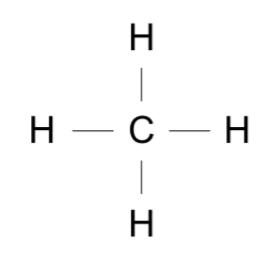
図6
図6はC-Hの結合エネルギー4つ分なので、
1664 ÷ 4 = 416 kJ/mol
⑶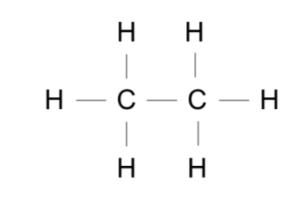
図7
331 + 416×6 = 2827 kJ
C-C C-H
おすすめ記事
- 大学受験必見!東大生が実際にしていたオススメの勉強法をご紹介します(化学編)
- 1. 原子の構造と化学結合~元素・イオン結合と電子配置の関係を知ろう~[大学受験化学-理論化学]
- 4.酸化還元反応〜酸化還元反応の反応式を立てられるようになろう〜[大学受験化学-理論化学]