私たちの身の回りにはカルシウムを含む様々な物質が存在しているとともに,いろんな用途で応用されています。大理石やセッコウ,石灰と呼ばれるものがその例です。
また,理科として皆さんにとって分かりやすい例として石灰水をあげることもできます。この記事ではどこにカルシウムが含まれているのか,そしてそれらはどのように応用されているのかを確認していきましょう。
Contents
カルシウムを含む物質
普通物質は純粋にその物質だけではなく,何かと結びついた状態で存在していることが多いです。
例えば鉄やアルミニウムといった物質も地中に多く含まれていますが,純粋な鉄やアルミニウムとして存在しているわけではないので,ただ地中から取り出せばいいというわけではありません。
地中では基本的には酸素と結びついた状態,すなわち「酸化鉄」や「酸化アルミニウム」として存在しており,酸化物の状態で取り出した後,様々な処理を行うことで純粋な物質を改めて得ることができるのです。
ここではカルシウムを含んだ物質ごとにその用途や性質を紹介していきましょう。
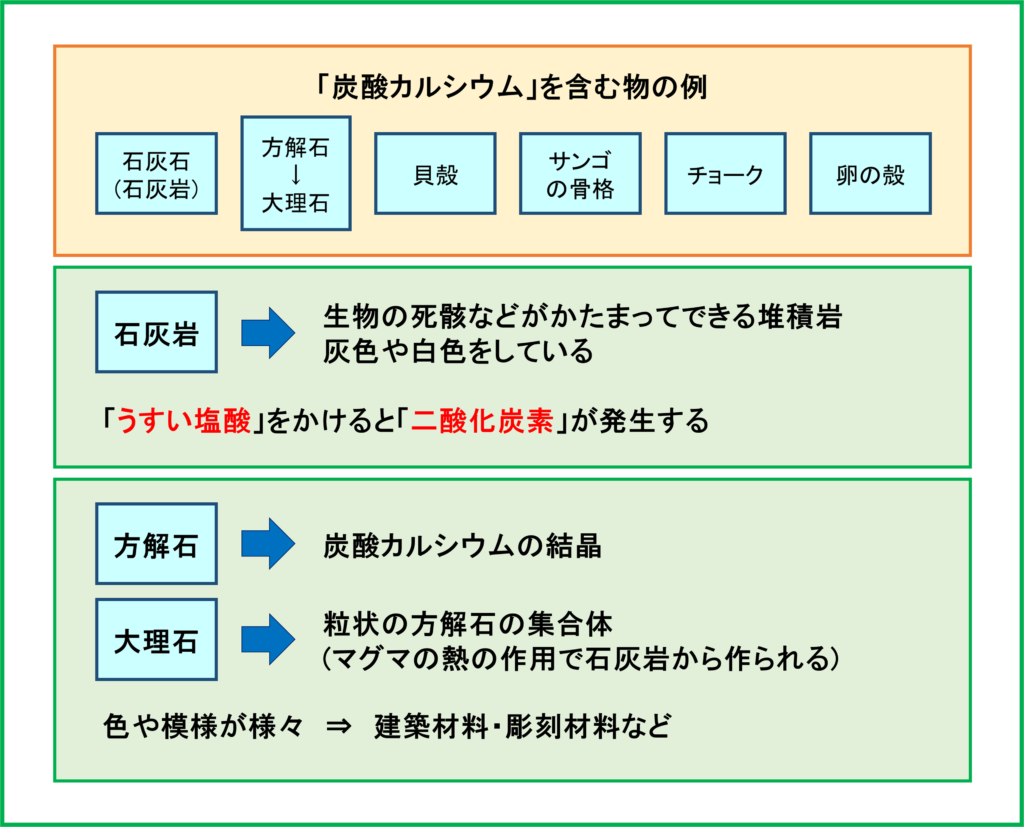
炭酸カルシウム
まずカルシウムが天然にどのようなところにあるのかを紹介します。
例えば「石灰石」や「大理石」と呼ばれるものに「炭酸カルシウム」の形で天然に存在しています。
「石灰石」は天然の岩石として呼ぶときは「石灰岩」と呼ばれるもので,生物の死骸などがかたまってできる堆積岩です。灰色や白色をしています。
また石灰岩は「うすい塩酸」をかけると,石灰岩に含まれる炭酸カルシウムと反応して「二酸化炭素」を発生する性質があります。地学の分野とも結びついてくるのでこのような点についても確認しておきましょう。
さらに炭酸カルシウムの結晶は「方解石」と呼ばれます。さらに石灰岩が火山や地中のマグマの熱による作用でより大きな方解石の結晶,粒状の方解石の集合体へと変化したものを特に「大理石」と呼びます。
大理石はその色や模様が様々であり,建築材料や彫刻材料としても用いられます。
炭酸カルシウムが含まれる身の回りのものとして,「貝殻」,「サンゴの骨格」,「チョーク」,「卵の殻」などが挙げられます。
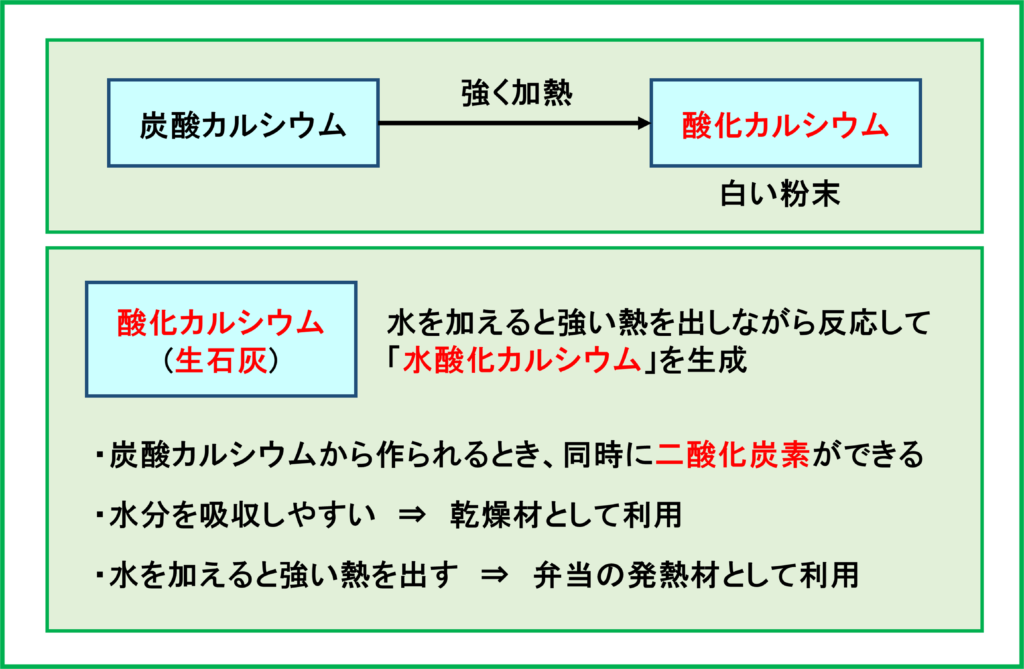
酸化カルシウム
炭酸カルシウムを強く加熱すると,「酸化カルシウム」が生成します。
酸化カルシウムは「生石灰」とも呼ばれ,水を加えると強い熱を出しながら反応して「水酸化カルシウム」ができます。「水酸化カルシウム」は白い粉末です。
酸化カルシウムの利用法として2つの例を紹介します。
まず,炭酸カルシウムを加熱して酸化カルシウムを作るとき,同時に二酸化炭素が発生するため,二酸化炭素を作る方法の1つとして利用されます。
また上で書いたように,酸化カルシウムは「水を加える」と「強い熱」を出します。この2つの性質は食品に対して利用されます。
まず「水を加える」の部分ですが,そもそも酸化カルシウムは「水分を吸収しやすい」という性質をもっています。これを利用し,「乾燥材」として用いられています。
次に「強い熱を出す」という点についてですが,水を加えたときの反応の熱を利用して弁当の簡易的な「加熱材」としても利用されています。
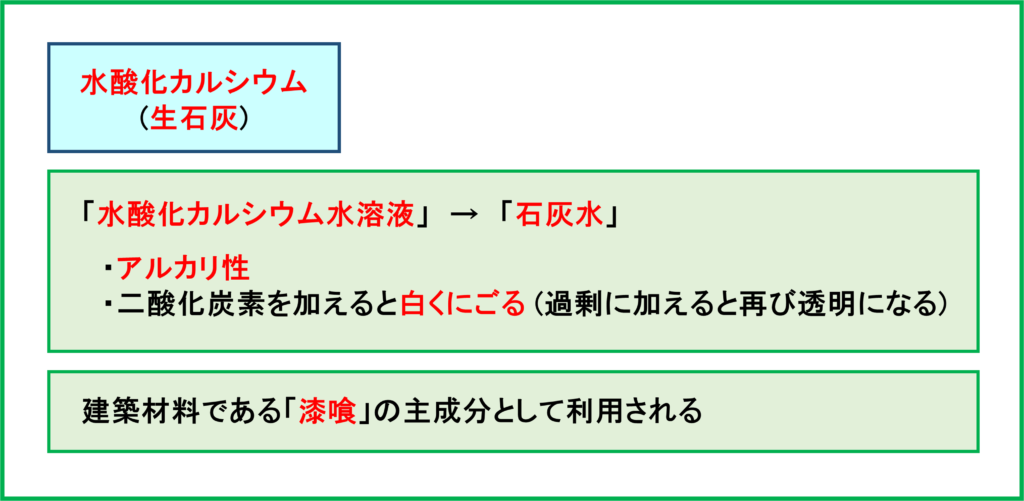
水酸化カルシウム
上で紹介したように,酸化カルシウムに水を加えると「水酸化カルシウム」が作られます。水酸化カルシウムは「消石灰」とも呼ばれています。
水酸化カルシウムを水に溶かしたものを「石灰水」といいます。つまり皆さんが理科で聞いたことのあるであろう「石灰水」はつまり「水酸化カルシウム水溶液」なのです。
石灰水は「アルカリ性」の水溶液で,「二酸化炭素」を加えると「白くにごります」。ちなみに白くにごった後にさらに二酸化炭素を加え続けると,白いにごりがさらに違う物質に変化して再び透明になります。
水酸化カルシウムの応用として,建築材料である「漆喰」が挙げられます。漆喰の主成分は水酸化カルシウムで,空気中の二酸化炭素と反応することで再び炭酸カルシウムへと戻り,長い年月をかけてかたくなっていきます。
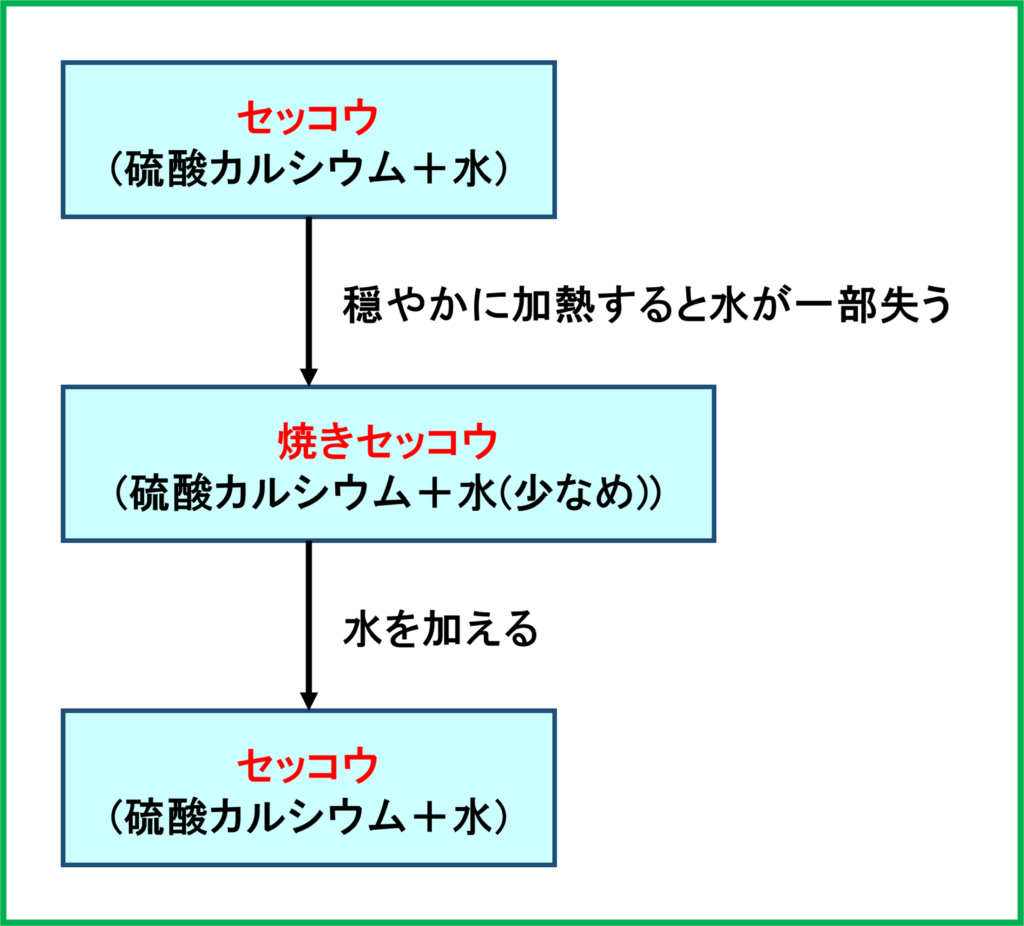
硫酸カルシウム
天然からとれるカルシウムとして,「セッコウ」が挙げられます。セッコウは「硫酸カルシウム」にいくつかの水が付いたものです。
これを穏やかに加熱していくと,セッコウについている水を一部失って「焼きセッコウ」ができます。そして焼きセッコウに水を加えると再び普通のセッコウへ戻ります。
このとき水を加えてから長時間かからないうちに形を整えると,そのうちセッコウとなってかたまり,セッコウ像が作られます。美術室にある顔の形をした白い像を見たことのある人もいると思います。あれがセッコウ像です。
入試問題演習
記事で学習したことを活かして,実際の入試問題に挑戦してみましょう。
問題



解答
- (1) 二酸化炭素
- (2) イ,オ,カ
- (3) 9.4 g
- (4) カ
- (5) イ
- (6) 0.72 g
解説
(1)
炭酸カルシウム(生石灰)に水を加えると水酸化カルシウム(消石灰)が作られますが,このとき同時に二酸化炭素が発生します。
(2)
「チョーク」や「たまごのから」,「貝がら」には「炭酸カルシウム」が含まれています。
またペットボトルの主成分はPET(ポリエチレンテレフタラート),1円玉の主成分はアルミニウム,10円玉の主成分は銅です。
(3)
問題文の例では「反応前の生石灰の重さ」:「吸収した水の重さ」=25:8となっていますが,表の他の例も見てみると,全て25:8となっています。例えば表の1番左の例で実際に計算してみると,
「反応前の生石灰の重さ」:「吸収した水の重さ」
=5.0:(6.6-5.0)
=5.0:1.6
=50:16
=25:8
つまり「吸収した水の重さ」の部分を3.0として計算してみると,
「反応前の生石灰の重さ」:「吸収した水の重さ」
=?:3.0=25:8
?:3.0=25:8 において,「=」より左の数は,「=」の右の数の3/8倍となっているので,
?=25×(3/8)=75/8=9.37…≒9.4
つまり約9.4gの生石灰が必要となります。
(4)
まず2kgの水の中に1gの生石灰を入れると考えると,水の量が2倍であるため,問題文と同じ0.34℃分を上昇させるには水が1gのときの2倍の熱が必要です。しかし今生石灰が同じ1gだとすると,半分(1/2)の温度しか上がらないと考えられます。つまりこの場合0.17℃温度が上がります。
ここで生石灰が3gあるとすると,上の3倍の熱が出ると考えられるので,
0.17×3=0.51
より,0.51℃水の温度が上がります。
(5)
石灰水は「アルカリ性」なので,BTB液を加えると「青色」に変化します。
(6)
グラフより,この濃さの石灰水と硫酸では100mLの石灰水を石こうへ反応させきるには25mLが必要です。つまり石灰水の1/4の量の硫酸があって初めて反応が完全に進行します。
つまり250mLの石灰水を反応させきるには,その1/4倍である62.5mLの硫酸が必要なので,今硫酸は足りていないことになります。つまり反応してできる石こうの重さは硫酸の方に合わせなければなりません。
グラフより,「入れた硫酸の体積」:「できた石こうの重さ」=25:0.3なので,硫酸の方を60とすると,
25:0.3=60:?
「=」より右の数は,「=」の左の数の60/25=12/5倍となっているので,
?=0.3×(12/5)=(3/10)×(12/5)=36/50=18/25=0.72
つまり0.72gの石こうができます。
まとめ
カルシウムは食べ物に含まれるだけでなく,身近なものに含まれていたり,建築材料や彫刻のモデルなど,広く応用されています。他にもどのような使い道があるのか,また他にカルシウムのように広く応用されている物質はどのようなものがあるのか調べてみましょう。
またここで紹介したカルシウムの性質をぜひ覚えておきましょう。詳しいことは高校化学で再び学習することになります。そのときこのような知識を前提として持っておくと,学習が進めやすくなります。


















