水溶液には酸性・中性・アルカリ性という性質がありますが,酸性とアルカリ性を混ぜると,互いにその性質同士を打ち消すような反応が起こります。
打ち消し合うために必要な水溶液の量は,その種類や濃度によっても違ってくるので問題として広く発展させやすい内容です。またこの性質は実験において酸性の水溶液やアルカリ性の水溶液を廃棄する際にも必要な知識となってきます。
ここではこの中和と呼ばれる反応に焦点をあてて学習をしていきましょう。
中和
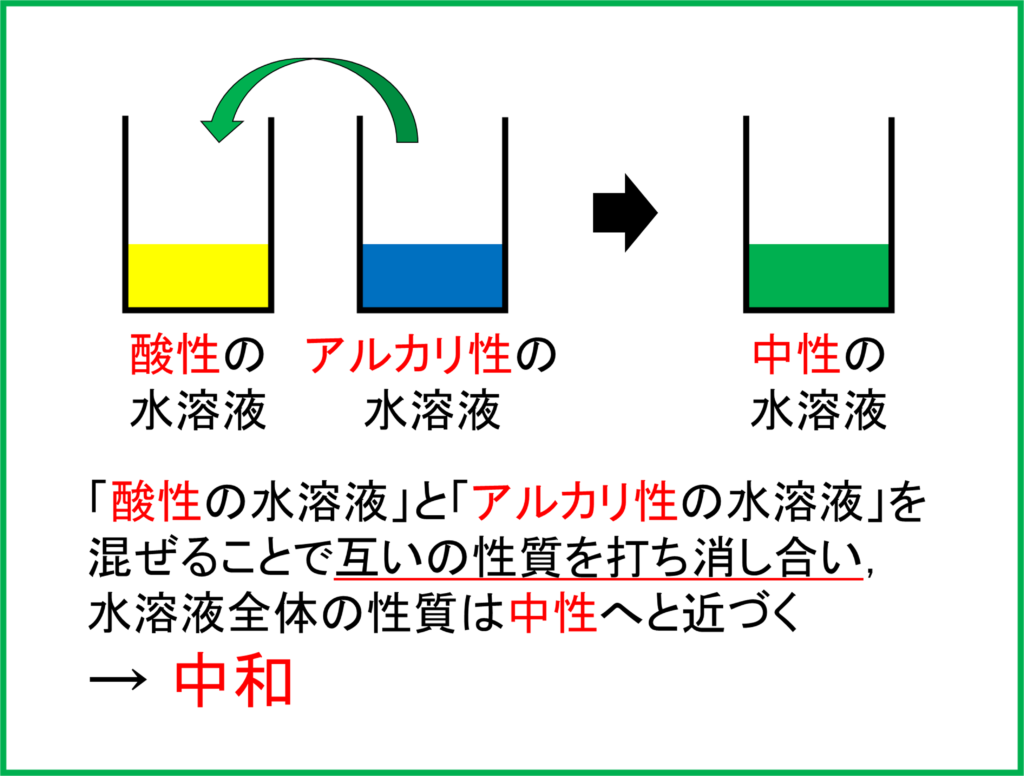
酸性の性質をもつ水溶液に,アルカリ性の性質をもつ水溶液を混ぜるとどうなるでしょうか。酸性とアルカリ性の水溶液同士を混ぜ合わせることでお互いの性質を打ち消し合い,中性へと近づきます。このような反応を中和と呼びます。
実際に中和が確認できる実験を紹介しましょう。
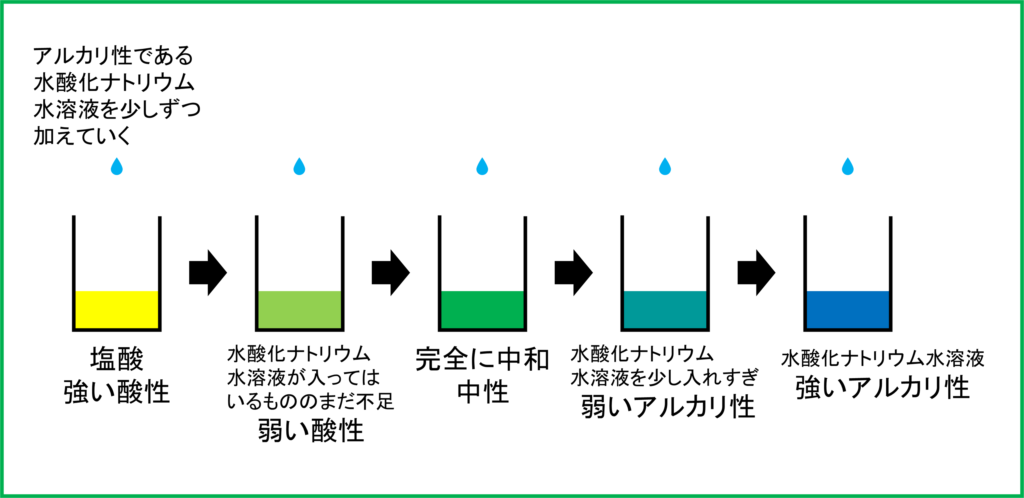
まず「BTB溶液を数滴たらした塩酸」を用意します。塩酸の性質は「酸性」なので,この時点では水溶液はBTB溶液によって「黄色」となっています。
ここへ,アルカリ性の水溶液である「水酸化ナトリウム水溶液」を少しずつ加えていくことをしてみます。すると塩酸の方の水溶液は次第に「緑色」となっていきます。
つまり酸性の塩酸とアルカリ性の水酸化ナトリウム水溶液を混ぜることによって水溶液は「中性」へと近づいているのです。
そして水溶液が緑色,すなわち中性になったあと,さらに水酸化ナトリウム水溶液を加えていくとどうなるでしょうか。
実際に加えていくと今度は「青色」になっていきます。つまり中性になった後も過剰に水酸化ナトリウム水溶液を加えることで水溶液全体が「アルカリ性」となっているのです。
上の実験からさらに分かることとして,ちょうど中性となるように中和するためには多すぎず少なすぎないような,ちょうどいい量同士を混ぜなければなりません。
酸性の水溶液が多すぎれば水溶液は全体で酸性となるし,逆にアルカリ性の水溶液が多すぎれば水溶液は全体でアルカリ性となります。
混ぜるべき水溶液同士の比は覚える必要はありません。高校化学となれば自分で導くことができますが,小中学生の時は中和のちょうどいい量が分かるような情報を問題中で提示してくれるのでまずは中和という反応の基礎をおさえることに集中しましょう。
さて次に中和した後の水溶液から「水を蒸発させる」とどうなるかを考えてみましょう。ここでは例として「塩酸」と「水酸化ナトリウム水溶液」を中和したものから水を蒸発させた場合を考えます。
すると白い物体が残ります。そしてこれを調べてみると水酸化ナトリウムではなく,「塩化ナトリウム」が出てきたものであることが分かります。
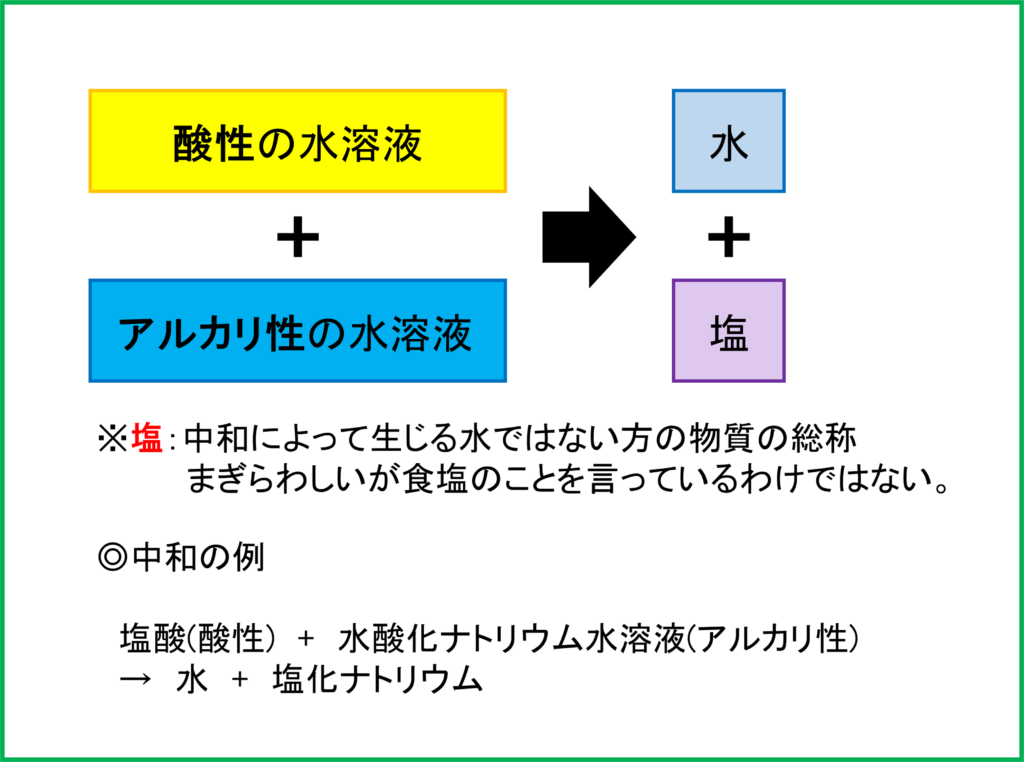
この塩化ナトリウムはどこから出てきたのでしょうか。ここで中和することでできる物質を考えてみましょう。
酸性の水溶液とアルカリ性の水溶液を混ぜて中和した場合,まず「水」ができます。そこに加えて「塩(えん)」と呼ばれる物質ができます。
ここでできる「塩」は中和させる酸性の水溶液とアルカリ性の水溶液の種類によって異なります。「塩酸」と「水酸化ナトリウム」の中和の場合は上のように「塩化ナトリウム」が塩として生成されます。

確認問題
上で学んだ内容を活かして,次の問題に挑戦してみましょう。
問題

解答
1
- (1) 中和
- (2) 水,塩
- (3) 水,塩化ナトリウム
2
- (1) 中性,緑色
- (2) 酸性,黄色
- (3) アルカリ性,青色
解説
1
(1)
酸性の水溶液とアルカリ性の水溶液を混ぜるとお互いの性質を打ち消すような反応が起こり,水溶液の性質は全体として中性に近づきます。この反応を中和といいます。
(2)
中和ではまず水が生成し,その他にも混ぜた水溶液の種類によって物質ができます。この物質を総称して塩と呼びます。
(3)
塩酸と水酸化ナトリウム水溶液を中和させると水が生じるとともに,塩として塩化ナトリウムが生じます。
実験などで塩酸や水酸化ナトリウム水溶液を捨てるときは,そのままだと危ないので中和して中性の水溶液にしてから捨てるのが好ましいです。
2
(1)
問題文より,この場合は塩酸と水酸化ナトリウムが10:8,つまり5:4のとき完全に中和します。
つまり塩酸20 mLを完全に中和するためには,
20:?=5:4より,16 mL必要です。
今,水酸化ナトリウムの量はぴったりなので水溶液は完全に中和し,水溶液は中性となります。
水溶液が中性なのでBTB溶液は緑色になります。
(2)
問題文より,塩酸10 mLを完全に中和するには水酸化ナトリウム水溶液が8 mL必要です。
しかし今水酸化ナトリウム水溶液は5 mLで8 mLには足りていないので,塩酸の酸性を打ち消しきれません。
よって水溶液の性質は,もとよりは弱くなるものの酸性のままです。
水溶液が酸性なのでBTB溶液は黄色になる。
(3)
(1)と同じように考えて,塩酸5 mLを完全に中和するためには水酸化ナトリウム水溶液が4 mL必要です。
今,水酸化ナトリウム水溶液は8 mLあり,必要な分よりも多いので,完全に中和した後にも余計に水酸化ナトリウム水溶液を加えていることになり,最終的にアルカリ性となります。
水溶液がアルカリ性なのでBTB溶液は青色になります。
入試問題演習
ここまでに学習してきたことを活かして,実際の入試問題に挑戦してみましょう。
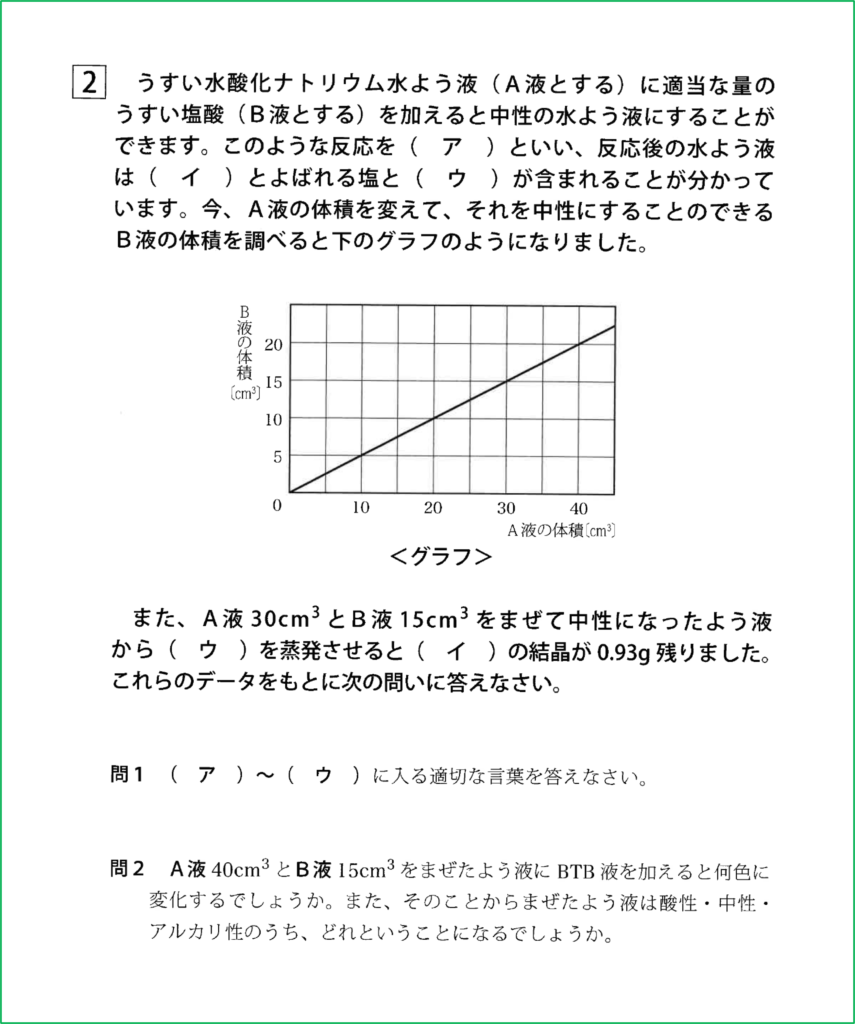
問題

解答
問1
- ア:中和
- イ:塩化ナトリウム
- ウ:水
問2 青色,アルカリ性
問3 1.24 g
問4 1.86 g
解説
問1
確認問題の大問1と同じ
問2
グラフより,A液とB液が2:1のときに完全に中和して水溶液が中性となることが分かります。
今,A液が40 cm3あるとすると,これを完全に中和するためには,
40:?=2:1より,?=20 cm3のB液が必要です。
今,B液は15 cm3しかないのでA液,すなわち水酸化ナトリウム水溶液のアルカリ性を打ち消すためには量が不足しています。
つまりこの条件ではアルカリ性が残ることになり,最終的に水溶液全体ではアルカリ性となります。つまりBTB溶液を加えると青色となります。
問3
A液とB液はちょうど40:20=2:1であるから,完全に中和します。
このとき塩化ナトリウムが生じますが,上の問題文からA液が30 cm3のときは塩化ナトリウムが0.93 g残るので,40 cm3のときは,
30:40=0.93:?の関係から計算すると,?=1.24 gとなります。
反応させる物質の量が2倍,3倍,…となればできる物質の量も2倍,3倍,…となるように,反応させる物質の量と生成する物質の量は比例関係にあることをおさえておきましょう。
問4
A液60 cm3を完全に中和するためには,
60:?=2:1より,?=30 cm3のB液が必要です。
今,B液は75 cm3と余計にあるので中和は完全に進行します。
しかしB液が反応しきる前にA液の酸性がなくなってしまうため,中和が完全に終わってからは中和の反応が起こらず,それ以上は塩化ナトリウムは生じません。
つまり生じる塩化ナトリウムの量はA液を基準にすればよいということになります。
ここで問3と同じように考えると,A液が30 cm3のときは塩化ナトリウムが0.93 g残るので,A液の量がその2倍である60 cm3のときは塩化ナトリウムも2倍の1.86 g生じることになります。
反応させる物質同士の量がちょうど良い比になっているとは限りません。少ない方の物質が反応で消費しきってしまえば多い方の物質はそれ以降反応せずに残ります。
この場合に反応でできる物質の量は,反応する物質のうち少ない方を基準にして考えましょう。
まとめ……の前に
登録6000人以上!
本サイト、中学受験ナビの監修も務めている『開成番長』こと繁田和貴が執筆する完全無料のメールマガジンでは、主に中学受験生のお子さんをお持ちの方へ向けた様々なお役立ち情報を配信中!
さらに今なら登録者にはもれなく「開成番長・繁田監修 中学受験必勝の5箇条PDF」をプレゼント!
登録及び登録解除も簡単ですので、お気軽にご登録ください。

まとめ
今回は中和について学習しました。その中でも水酸化ナトリウムを加えたことによる色の変化はよく聞かれるので、変化のタイミングとその色についてはまとめて覚えるようにしましょう!


















