Contents
酸化と還元とは…?
酸素も用いた定義
まずはじめに酸素を用いた定義がなされた。
我々が日頃、鉄がさびた、酸化された、などを言っているのと同じで、
物質がO2と結びつくことを酸化、物質がO2を失うことを還元
と定義した。
Ex)
- 2Cu+ O2→2CuO
Cu : 酸化された - 2CuO+C→2Cu→CO2
CuO : 還元された
C : 酸化された
水素を用いた定義
次に、多くの化合物に含まれる水素を用いた定義がなされた。
これにより、O2の時よりは多くの反応に適用できるようになった。定義としては、
物質がH2を失うことを酸化、物質がH2と結びつくことを還元
というものである。
- Ex) CH4+2O2→CO2+2H2O
CH4: 酸化された
O2 : 還元された
電子を用いた定義
最後に、H2もO2も含まない反応にも適用できるよう、電子を用いた定義がなされた。我々はこの定義をこれから採用していく。
すなわち、
物質がe–を失うことを酸化、e–を受け取ることを還元
と定義する。
- Ex) 2Cu+O2→2CuO においてCuはCu→Cu2+へと変化している。
陽イオンになっているので、Cu→Cu2++2e–のようにe–を失っており、Cuは酸化されている、とみなせる。
ここで失われたe–はもちろん消えていることはなく、相手のO2へとわたることで反応が成り立っている。
実際、O2→2O2-と陰イオンへと変化しているのでe–を受け取っており、O2は還元されている。
このように考えると、e–を失うものがいれば必ずe–を受け取るものがいるはずなので、酸化と還元はコインの表と裏のように必ず同時に起こる。
これを酸化還元反応といい、まとめると本質はe–のやり取りである。
酸化数
e–のやり取りという定義は広く使えるものの、反応式を見てすぐに判断しにくいというデメリットがある。
特に共有結合のCO2の反応ではイオンに分解して考えられないので大変。
そこで、以下のルールに従い、各原子に酸化数という数字を定め、その値から電子の授受を判断することにする。
意味としてはある化合物中の元素が、単体の時と比べてどのくらいe–を多くor少なく持っているのかを示している値である。
〈酸化数のルール〉
- 単体の酸化数は0とする。
Ex) H2、O2、Cuの酸化数はどれも0。 - 化合物中のHの酸化数は+1、Oの酸化数は-2とする。
ただしH2O2においてのみOの酸化数を-1とする。
Ex) CH4のHは酸化数+1 - 伝記的に中性な化合物は、酸化数の総和が0に、イオンについては酸化数の総和がそのイオン価数に一致するようにする。
Ex) H2O:Hが+1、Oが-2より (+1)×2+(-2)=0
OH–:Oが-2、Hが+1より (-2)+(+1)=-1 - 典型元素はその族番号から予測されるイオン価数と酸化数が一致。
Ex) Naは酸化数は+1
★練習あるのみ!下線の原子の酸化数をふろう!
- Ex1) CO2 :Oが(-2)なので和が0になるにはCは+4
MnO42- :Oが(-2)なので和が -1になるにはMnは+7
1.I2 2.NH3 3.Fe2O3 4.NO3– 5.H2SO4 6.CuO 7.Cu2O
8.Cu 9.H2O2 10.H2S 11.H2 12.Cr2O72- 13.CuSO4
このようにして付けた酸化数をもとに、酸化数が増えたら酸化され、酸化数が減ったら還元されている
- Ex2) 2 Cu O + C → C O2 + 2Cu
[左辺]Cu(CuO) : +2
O(CuO) : -2
C : 0
[右辺]C(CO2 ) : +4
O(CO2 ) : -2
Cu : 0
Cuは+2→0と減っているのでCuOは還元されており、Cは0→+4と増えているので酸化されている。 - Ex3) N2 + 3H2 → 2 N H3
[左辺]N2 : 0
H2 : 0
[右辺]N(NH3) : -3
H3(NH3) : +1
よりN2は0→-3なので還元され、H2は0→+1なので酸化されている。
まとめると… 酸化されるとは 還元されるとは
O2を 受け取る 失う
H2を 失う 受け取る
e–を 失う 受け取る
酸化数 up down
酸化剤と還元剤
酸化剤…相手を酸化する物質。自身は還元されるので注意。
還元剤…相手を還元する物質。自身は酸化されるので注意。
これらの用語はかなりよく用いるので必ず覚えておく。
酸化と還元はコインの表と裏のように同時に起こるので、相手を酸化するということは自身は還元されるということである。
- Ex) 2 K I + Cl2 → I2 + 2KCl
[左辺]K(KI) : -1
Cl2 : 0
[右辺]I : 0
Cl(KCl) : -1
Iが-1→0なので酸化されているため、KIは還元剤であり、Clが0→-1なので還元されているため、Cl2は酸化剤となっている。
《代表的な酸化剤と、その反応後(自身は還元されて変化する)の物質(イオン反応式)》
- 酸素 O2 → 2H2O
- ハロゲン Cl2 → 2Cl– (F2、Br2、I2も同様)
- オゾン O3 → O2
- 過マンガン酸カリウム(硫酸酸性) MnO4– → Mn2+
- 過マンガン酸カリウム(中性~塩基性) MnO4– → MnO2
- 二クロム酸カリウム Cr2O72- → 2Cr3+
- 二酸化マンガン MnO2 → Mn2+
- 濃硝酸 NO3– → NO2
- 希硝酸 NO3– → NO
- 熱濃硫酸 H2SO4 → SO4
- 過酸化水素 H2O2 → 2H2O
- 二酸化硫黄 SO2 → S
《代表的な還元剤と、その反応後の物質(イオン反応式)》
- 金属単体 Na → Na+ (Mg→Mg2+も同様。)
- ハロゲン化物イオン 2Cl– → Cl2 (F–、Br–、I–も同様)
- 酸化銀(Ⅱ) Fe2+ → Fe3+
- 塩化スズ(Ⅱ) Sn2+ → Sn4+
- 硫化水素 H2S → S
- シュウ酸 (COOH)2 → 2CO2
- チオ硫酸ナトリウム 2S2O32- → S4O62-
- 水酸化物イオン 4OH– → O2
- 過酸化水素 H2O2 → O2
- 二酸化硫黄 SO2 → SO42-
H2O2とSO2は酸化剤にも還元剤にもなりうるので注意。上に示した、酸化剤・還元剤とその変化後の物質は必ず覚えること!
酸化還元反応の反応式のたて方
反応式の立て方の手順
酸化還元反応の全体の反応式は以下の手順で立てる。
- 酸化剤・還元剤それぞれの半反応式をたてる。
- 2つの半反応式を組み合わせる。
- 欠けているイオンを補う。
今回は硫酸酸性条件のKMnO4を酸化剤、二酸化硫黄SO2を還元剤として酸化還元反応をたててみる。
半反応式をたてる
半反応式というのは酸化剤または還元剤がe–を受け取ったり放出したりする様子を表したもので、片方の物質にのみ注目する、いわゆる半分の反応式のこと。
ⅰ 反応前後の物質を書く。
MnO4– → Mn2+ (酸化剤)
SO2 → SO42- (還元剤)
ⅱ 反応の前後でO原子の数が等しくなるようにH2Oを用いて合わせる。
MnO4– → Mn2+ + 4H2O
SO2 + 2H2O → SO42-
ⅲ 反応の前後でH原子の数が等しくなるようにH+を用いて合わせる。
MnO4– + 8H+ → Mn2+ + 4H2O
SO2 + 2H2O → SO42- + 4H+
ⅳ 反応の前後で電荷(+や-)の和が等しくなるようにe–を用いて合わせる。
MnO4– + 8H+ + e– → Mn2+ + 4H2O (酸化剤の半反応式)
SO2 + 2H2O → SO42- + 4H+ + 2e– (還元剤の半反応式)
以上の手順を持って酸化剤・還元剤の半反応式は完成した!
ここで、他の全ての酸化剤・還元剤についても同様に半反応式をたててみよう。
(酸化剤)
- O2 + 4H+ + 4e– → 2H2O
- Cl2 + 2e– → 2Cl–
- O3 + 2H+ + 2e– → O2 + H2O
- MnO4– + 8H+ + 5e– → Mn2+ + 4H2O (酸性)
- MnO4– + 4H+ + 3e– → MnO2 + 2H2O (中性~塩基性)
- Cr2O72- + 14H+ + 6e– → 2Cr3+ + 7H2O
- MnO2 + 4H+ + 2e– → Mn2+ + 2H2O
- NO3– + 2H+ + e– → NO2 + H2O(濃)
- NO3– + 4H+ + 3e– → NO + 2H2O(希)
- H2SO4 + 2H+ + 2e– → SO2 + 2H2O
- H2O2 + 2H+ + 2e– → 2H2O
- SO2 + 4H+ + 4e– → S + 2H2O
(還元剤)
- Na → Na+ + e–
- 2Cl– → Cl2 + 2e–
- Fe2+ → Fe3+ + e–
- Sn2+ → Sn4+ + 2e–
- H2S → S + 2H+ + 2e–
- (COOH)2 → 2CO2 + 2H+ + 2e–
- 2S2O32- → S4O62- + 2e–
- 4OH– → O2 + H2O + 4e–
- H2O2 → O2 + H+ + 2e–
- SO2 + 2H2O → SO42- + 4H+ + 2e–
となる!
2つの反応式を組み合わせる
酸化還元反応ではe–のやり取りがぴったり行われる。そのため①でたてた2つの半反応式に関してe–の数を合わせて足してあげることでe–の反応式から消去する。
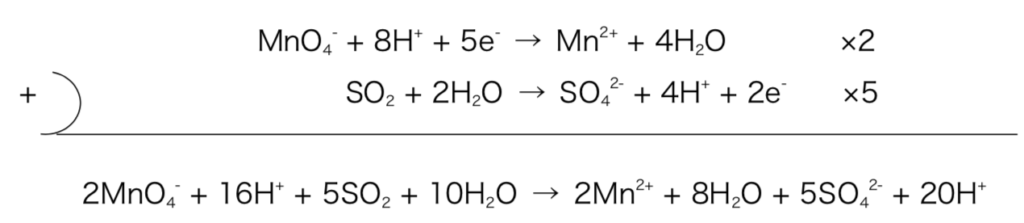
図1
左辺と右辺で同じ物質がある場合は引いて整理する。
2MnO4– + 5SO2 + 2H2O → 2Mn2+ + 5SO42- + 4H+
欠けているイオンを補う
ここで、化学反応式にイオンが残っていてはいけない。そのため、元の化合物の形を考えて-のイオンと+のイオンを組み合わせてイオンを戻してあげる必要がある。
まず、MnO4–はもともと過マンガン酸カリウムKMnO4であったため、この形に戻してあげるべく、両辺に2K+を足してあげる。
そして、硫酸酸性条件下だったため、H+はすべてH2SO4由来であるので、そこも戻してあげる。あとは残った+と-のイオンを組み合わせてあげればよい。
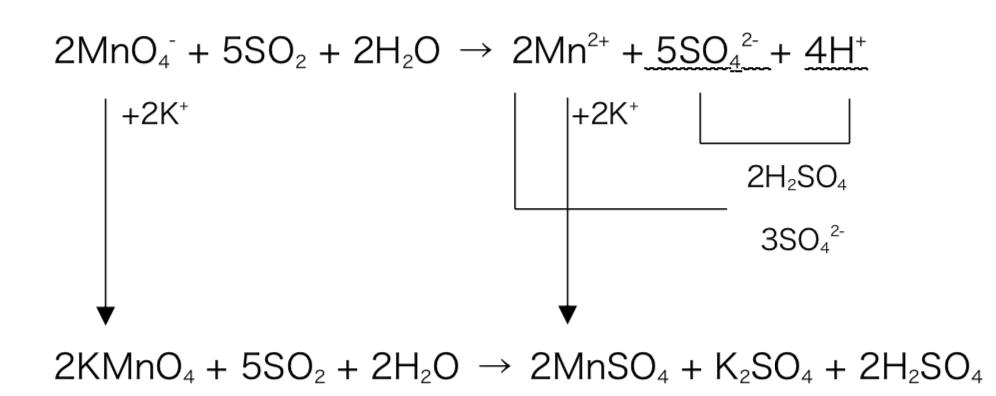
図2
これで完成!
- Ex)ヨウ化カリウム水溶液と過酸化水素を硫酸酸性条件下で作用させた時の化学反応式を記せ。
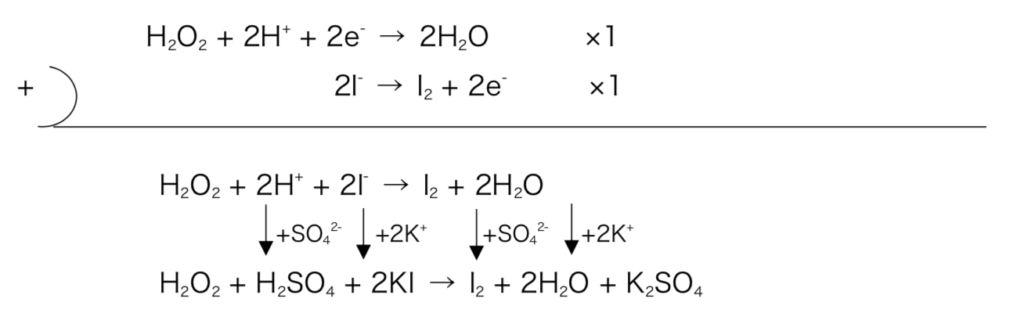
図3
- Ex2)二クロム酸カリウムと二酸化硫黄を硫酸酸性条件下で反応させた時の化学反応式を記せ。
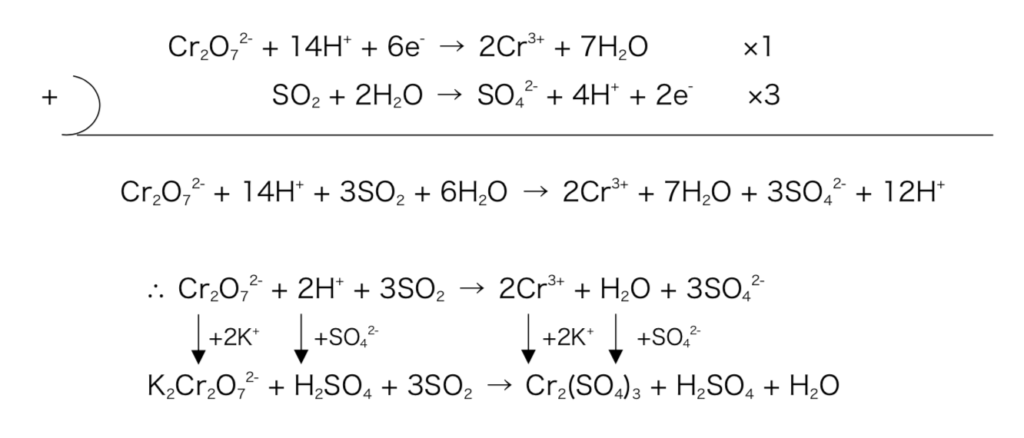
図4
酸化還元滴定
酸化還元滴定とは
中和滴定と同様に酸化還元反応においても、ビュレットによる滴定で濃度未知の酸化剤・還元剤の濃度を求めることができる。
ただし、中和の時とは違い、pHの変化が特徴的ではないので、滴定の終点を知るための色の変化を伴う指示薬が問題となる。
KMnO4滴定
KMnO4が赤紫色であることを利用した滴定。
濃度が未知の還元剤に対し、KMnO4を滴定していき、KMnO4の赤紫色が消えずに残った瞬間を反応の終点とする。(KMnO4が余りはじめたことを意味する。)
- Ex) 濃度未知の過酸化水素水0mLをビーカーに取り、硫酸酸性にした後、0.01mol/Lの過マンガン酸カリウムを滴下していった。すると16.0mLを加えたところで赤紫色が消えなくなった。この時、過酸化水素の濃度は?
(解き方①)反応式をたてて係数比
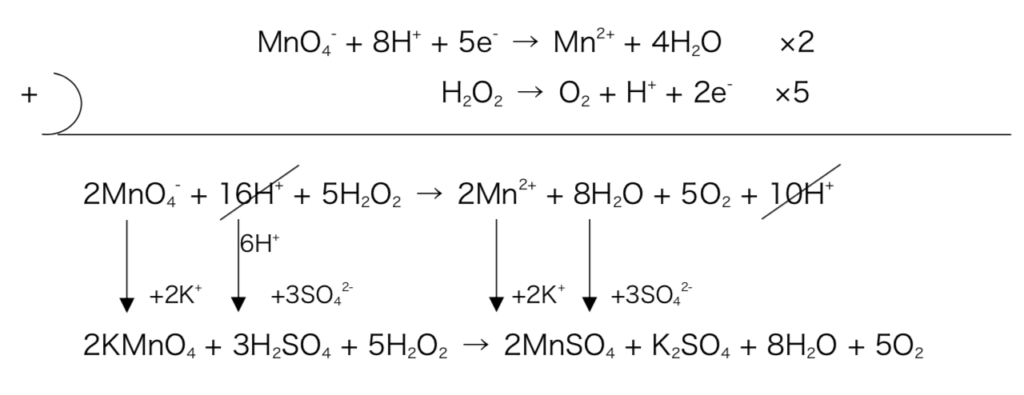
図5
よって係数比に注目し、
( KMnO4のmol ) × = ( H2O2のmol )
∴ 0.04mol/L
この解き方は確実だが、若干大変。
(解き方②) e–の移動に注目
わざわざ全反応式を立てなくても半反応式だけを見ればOK。
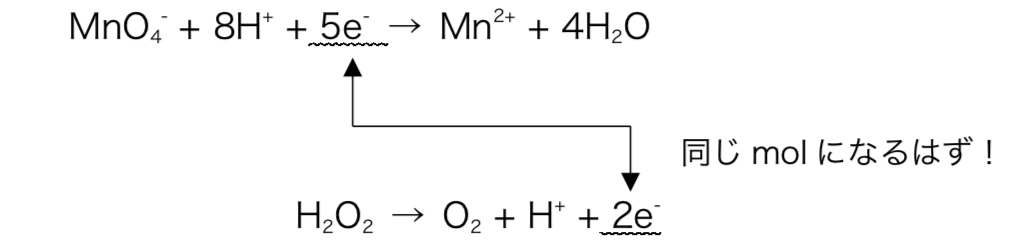
図6
e–の授受は余りなく完全に行われるので、2つの半反応式においてe–のmolは等しくならなければならない。
よって、( 酸化剤の受け取るe–のmol )\(\times\frac{5}{2}\)=( 還元剤の放出するe–のmol )
\(∴x= 0.04mol/L\)こちらの方が楽なのでオススメ。
★発展 ※硫酸酸性にする理由
→MnO4–はMn2+へと変化させるためにOイオンを4つ取って還元させなければならないが、その際十分にH+が存在しないとMnイオンとOイオンの間にはたらくクーロン力を弱められないからだと考えられる。
そのため、H+は十分にない中~塩基性ではOイオンが2つしか取れず、MnO4– →MnO2で止まる。そして、酸性にするためにHClやHNO3は使えない。
HClはCl–が還元剤となり、HNO3は酸化剤として反応に関与してしまうからである。一方でH2SO4は基本的には酸化剤になり得ない。
これはSの電気陰性度があまり大きくなく、e–を受け取って還元される力が強くないからである。そこでH2SO4は熱濃硫酸にしないと酸化剤にならず、普通のH2SO4は酸性条件にするのに適している。
※KMnO4でなくK2Cr2O7でも滴定は可能である。Cr2O72- → 2Cr3+の変化で橙黄色→緑色へと変化するため、この変化が起こらなくなった点が終点となるが、見にくいのでKMnO4の方がよく用いられる。
ヨウ素滴定(発展)
→KMnO4の方法では還元剤の濃度しか求められない。たとえば酸化剤KMnO4自身の濃度が未知の場合などはヨウ素滴定を用いる。
濃度未知の酸化剤を濃度既知の還元剤で同じように滴定すればいいだけに見えるが、うまく色の変化する還元剤がなく、終点が見分けられないのが課題。そこで以下のステップを踏む。
〈step1〉
濃度未知の酸化剤に過剰量のヨウ化カリウム(還元剤)を入れてI2を発生させる。(過剰量なので終点を見分ける必要なし!)
〈step2〉
出てきたI2を酸化剤として、還元剤で濃度既知のチオ硫酸ナトリウムNa2S2O3により滴定する。この際、デンプンを入れヨウ素デンプン反応によって青紫色が消えた点を終点とする。
(酸化剤をI2に切り替えることで色の変化を見ることに成功!)
この方法により、step2からI2のmolが分かり、そこから逆算してstep1に戻ってあげると酸化剤のmolが分かるので濃度が求まる。
- Ex) 濃度未知のH2O2溶液を0mL取り、そこに過剰量のKIと硫酸を加えた。その後0.2mol/LのNa2S2O3溶液で滴定したところ、滴定終了まで10.0mLを要した。
まずStep1

図7
次にStep2
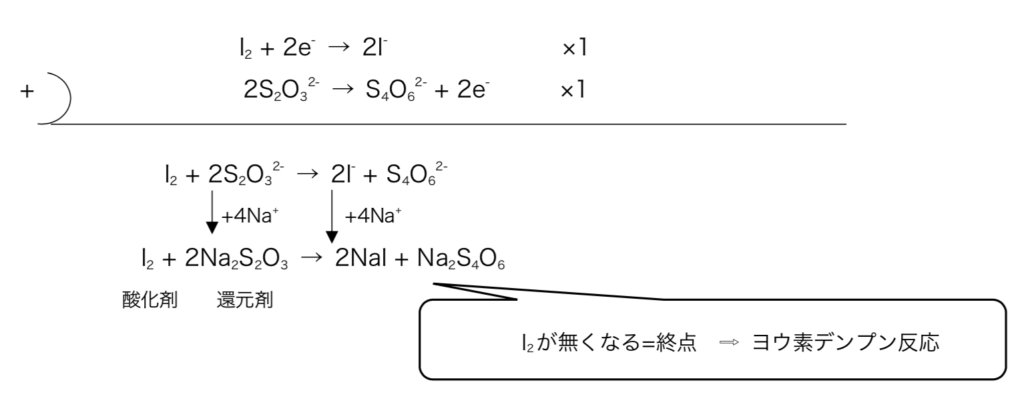
図8
Step2より ( 反応したNa2S2O3のmol )=( I2のmol )×2
\(0.2\times\frac{10}{1000}=x\times2\)
∴x = 1.0×10-3 mol
Step1より ( I2のmol )=( H2O2のmol )
よってもともとあったH2O2は1.0×10-3 mol。
これが10.0mLなので
1.0×10-3 mol / 0.01L = 0.10 mol/L と分かる。
おすすめ記事
参考