Contents
酸塩基反応の概要
高校化学で扱う化学反応は大きく分けて3つに分けられる。
- 酸・塩基反応…H+とOH–による中和反応
- 酸化還元反応(第4章) …e–のやり取りによる反応
- 沈殿生成反応(無機化学)…特定の物質に関する特別な反応
この3つを学ぶと、理論上、全ての化学反応式が書けるようになる!
酸・塩基(≒アルカリ)の定義
アレニウスの定義
アレニウスの定義…
酸とは水中でH+を出すもの、塩基とは水中でOH=を出すもの
- Ex1)
HCl(塩酸)は水中でHCl→H++Cl–をとH+を出すので酸である。
H2SO4(硫酸)も水中でH2SO4→2H++SO42-となり、H+を出すので酸である。 - Ex2)
NaOH(水酸化ナトリウム)は水中でNaOH→Na++OH–とOH–を出すので塩基である。
NH3(アンモニア)は水中でNH3+H2O→NH4++OH–となりOH–を出すので塩基である。
※このようにHCl→H++Cl–のように+と-のイオンに分かれることを電離という。
しかし、この定義は直観的には分かりやすい一方で、水以外の溶媒では定義できない、などの限定的だったので、その後改良された定義が発表された。
ブレンステッド・ローリーの定義
ブレンステッド・ローリーの定義…
酸とは相手にH+を与えるもの、塩基とは相手からH+を受け取るもの
この定義は最も軽くて動きやすいH+の動きがもとになっており、液体に限らず広く使える定義となっている。
Ex)
- HCl + H2O → H3O+ + Cl–
HCl : H+を与えている酸
H2O : H+を受け取っている塩基 - NH3 + H2O → NH4+ + OH–
NH3 : H+を受け取っている塩基
H2O : H+を与えている酸
※このようにH2Oは反応によって酸になることも塩基になることもある。
(ただし、酸はH+、塩基はOH–という直観的に分かりやすいアレニウスの定義の方が高校化学ではよく用いられている。)
代表的な酸・塩基
〈1価の酸〉…H+を1つ持つもの。
HCl(塩酸)、HNO3(硝酸)、CH3COOH(酢酸)
〈2価の酸〉…H+を2つ持つもの。
H2SO4(硫酸)、(COOH)2(シュウ酸)
〈3価の酸〉…H+を3つ持つもの。
H3PO4(リン酸)
〈1価の塩基〉…OH–を1つ持つもの。
NaOH(水酸化ナトリウム)、KOH(水酸化カリウム)、NH3(アンモニア)
〈2価の塩基〉…OH–を2つ持つもの。
Ca(OH)2(水酸化カルシウム)、Ba(OH)2(水酸化バリウム)
〈3価の塩基〉…OH–を3つ持つもの。
Al(OH)3(水酸化アルミニウム)
電離度と酸・塩基の強弱
先述した通り、HCl→H++Cl–のようにイオン化合物が溶液中で+の陽イオンと-の陰イオンに分かれることを電離という。
この電離は必ずしも完全に起こるわけでなく、物質によっては一部しか電離しないものもある。
その電離する割合を電離度という。
\(電離度α=\frac{電離したmol}{溶解したmol}\)
と表される。
- Ex1)CH3COOH 4molの内、1molしか電離しなかった場合、電離度α=1/4=0.25となる。
- Ex2)HCl4molを水に溶かすと4mol全てが電離するので電離度α=1となる。
ここで、電離度α=1の酸・塩基を強酸・強塩基とし、α≪1の酸・塩基を弱酸・弱塩基と定義する。
意味としては、α=1ということは HCl→H++Cl–、NaOH→Na++OH–という電離が100%起こるということなので、H+、OH–を出す力が強いということで、アレニウスの定義に沿って強酸・強塩基と理解しやすい。
⇨1価、2価…は酸の強弱とは全く関係ない。
★ここで、有名な強酸・今日塩基は覚えておこう!
強酸…HCl、HNO3、H2SO4、HBr、HI
強塩基…NaOH、KOH、Ca(OH)2、Ba(OH)2
水のイオン積とpH
水のイオン積
化学において、物質のモル濃度を表す際には、[ ]をつけて表すことになっている。
- Ex1) H+のモル濃度[H+]=1.0×10-5 mol/L
- Ex2) OH–のモル濃度[OH–]=1.0×10-9 mol/L
いま、水中ではH2Oが一部電離し、
H2O⇄H++ OH–
というようにH+とOH–が混在している。
この2イオンはH+が増えるとOH–が減り、H+が減るとOH–が増えるといったように、バランスが保たれている。
数字としては25℃では、
[H+][OH–]=1.0×10-14 mol2/L2
を常に満たしている。
これを水のイオン積といい、詳しくは10章で扱う。
pH
このように水溶液中でバランスの保たれているH+濃度を用いて、pHという概念をここで導入する。
pHとはその水溶液の酸性・塩基性の強さを表す数値で、0~14の範囲で表される。(化学では酸性の対になる概念をアルカリ性=塩基性という)

図1 pH概念
酸性の度合いを表す。
このpHはH+の濃度と以下のようなつながりを持つ。
\(pH=-log_{10}=[H^{+}]↔︎([H^{+}]=1.0×10^{-pH}mol/L)\)
意味としては[H+]の濃度が大きいほどpHとしては小さい数になり、酸性として強くなっている。
- Ex1) [H+]=1.0×10-4のときpH=4で酸性。(しょうゆはこのくらい)
- Ex2) [H+]=1.0×10-11のときpH=11で塩基性。
- Ex3) pH4とpH5ではH+濃度が10倍異なる。
(pH4→[H+]=1.0×10-4、pH5→[H+]=1.0×10-5より)
★発展 - Ex4) [H+]=3.0×10-3のとき、
pH= -log10(3.0×10-3)
= -log103 -log1010-3
= 3 -log103 ※log103≒0.48
= 2.52 (レモン汁はこのくらい)
と求まる。 - Ex5) 0.02 mol/LのHCl溶液のpHを求める。
HClは強酸なので電離度α=1でほぼ100%電離する。
つまり、HCl→H++Cl– が完全に起こるので0.02mol/L
[H+]=0.02 mol/L =-2.0×10-2
よってex4)よりpH= -log10(2.0×10-2) = 2 -log102 = 1.7 と求まる。 - Ex6) 0.1 mol/LのCH3COOH溶液の電離度α=0.01のとき、pHを求める。
CH3COOH→CH3COO– + H+
CH3COOH : 0.1mol/L
電離度=0.01つまり1/100しか電離しないので[H+]=0.1×0.01=1.0×10-3 mol/L
よってpH=3と求まる。
中和反応
(H+を持つ)酸と(OH–を持つ)塩基が反応し、それぞれの性質を互いに打ち消し合うような反応のことを中和反応という。
例をいくつか見ていくのが分かりやすい。
- Ex1 ) HCl + NaOH → NaCl + H2O
- Ex2) CH3COOH + NaOH → CH3COONa + H2O
- Ex3) HNO3 + KOH → KNO3 + H2O
これらの例を見て分かるように中和反応では酸の持つH+と塩基の持つOH–が結びついて必ずH2Oを作っている。
これこそが中和反応の本質である。(厳密にいうと、酸の電離により分かれて出てきたH+と塩基の電離により分かれて出てきたOH–が結合する反応といえる。)
そのため、2価の酸の中和反応なら2倍のH2Oが生成する。
- Ex4 ) H2SO4 + 2NaOH → Na2SO4 + H2O
- Ex5) 3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
H+ 2つ OH– 3つ
ここでNaCl、CH3COONaのように中和反応により生じたH2O以外のもののことを塩(えん)という。
(★発展:
弱酸であるCH3COOHは電離度が小さく、あまり電離しないので、H+があまり生じず、中和があまり起こらないように見えるがそんなことはない。
はじめにわずかに生じたH+が中和すると、減った分のH+のバランスを保とうと、その後のCH3COOHの電離が促進される。
これを繰り返していくと、中和はほぼ100%進行する。
これをルシャトリエの原理というが詳しくは10章で扱う。)
中和反応の量的関係
実際の中和反応をて分かるように、酸から出るH+と塩基から出るOH–は mol比が1:1で反応し、H2Oを生成する。
これを基に、中和反応に必要な酸・塩基の量を計算することができる。
【例題】
- 0.10 mol/LのHCl 20mLとちょうど中和する20 mol/LのNaOHは何mLか?
- 0.1mol/LのH2SO4 20mLとちょうど中和する20mol/LのNaOHは何mLか?
【解答】
- HCl + NaOH → NaCl + H2Oが化学反応式となる。
まずH+の molを考えると、
1L 0.1 mol
20mL □ mol ∴ □=\(0.1 \times\frac{20}{1000}\) mol
次にOH–のmolを考える。これはH+のmolと等しくならなければならないので
=2.0×10-3 molである。よって、NaOHは
1L 0.2 mol
□mL 2.0×10-3 mol
より、10mLと分かる。
このようにH+のmolとOH–のmolを考えてイコールで結んであげれば中和の計算は全て可能である。
また2価や3価の酸・塩基であると少し注意が必要である。 - 化学反応式は H2SO4 + 2NaOH → Na2SO4 + H2O
同様にして、(H+のmol)=(OH–のmol)
\(0.10\times\frac{20}{1000}\times2=0.2\times\frac{□}{1000}\times1 …★\)∴ □ = 20mL と求まる。
H2SO4 が2価の酸なのでH+は2倍である。
中和反応の計算をする上で、この★にあたる式は必ずたてることになるので、以下のような公式も出来ている。
酸の濃度×体積×価数=塩基の濃度×体積×価数
結局、(H+のmol)=(OH–のmol)の式なので、覚える必要はないが、覚えておくと便利な式ではある。
中和滴定と指示薬
中和滴定・指示薬・pHジャンプとは
中和反応の量的関係で見た中和計算を用いると、酸か塩基の片方の濃度が未知であっても実験により中和に必要な体積さえ分かれば、計算により濃度を求めることができる。このような操作を中和滴定という。
- ビュレット…主にNaOH溶液など濃度の分かっている酸・塩基を入れ、1滴ずつ滴下していく道具。
- コニカルビーカー…濃度の分からない酸・塩基を入れておく。
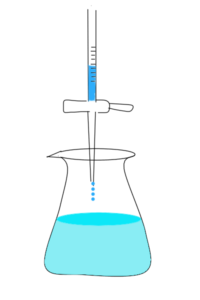
図2 上:ビュレット、下:コニカルビーカー
このようにビュレットを用いて少しずつ酸・塩基を入れていき、中和反応が起こり始めたところで止めることで、その滴下量から中和に要する体積が分かる。
中和反応が起こり始めたことの判定は指示薬を用いて行う。
指示薬とはあるpHになると色が変わるような溶液のことである。
濃度未知のHClに濃度既知のNaOHを入れていくと、はじめは酸性だが、入れるNaOHが増えていくとだんだんと中和されるHClの量が増え、pHが上がっていき、ある完全にぴったりの量を超えるとNaOHが余りはじめる。
すると一気に塩基性になる。すなわち、塩基性で色の変わる指示薬を入れておけば、ぴったり中和する量が分かる。
この酸性だった溶液が、中和にぴったりの量を一滴こえた瞬間にすぐに塩基性へと変わる様子をpHジャンプと呼ぶ。
いくつかの例を用いた中和滴定曲線
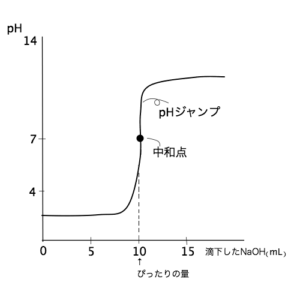
図a
- 図aは先述した通り、HClにNaOHを滴下していったときの中和滴定曲線である。
10mL滴下するまではHClが余っており酸性で、10mL滴下して完全中和しpHがジャンプが起きて、それ以降はNaOHが余っていくため塩基性になっている。
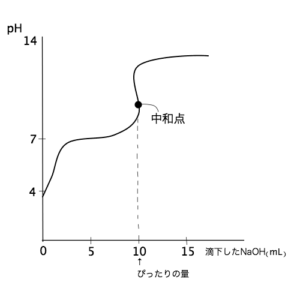
図b
- 図bはCH3COOHにNaOHを滴下したときの曲線。
CH3COOHは弱酸なのでpHの高いところからスタートするため、中和点が塩基性側によっている。
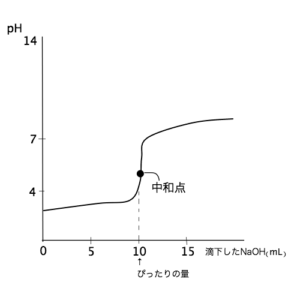
図c
- 図cはHClにNH3を滴下したときの曲線。
NH3は弱塩基なのでpHがあまり高くならず、中和点が酸性側によっている。
つまり、使う酸と塩基の組み合わせによって中和点のpHが変わる。
すると、使える指示薬も変わってくるのだが、ここで代表的な指示薬を2つ紹介しておく。
- メチルオレンジ(MO)…変色域はpHが3.1~4.4
- フェノールフタレイン(pp)…変色域はpHが8.0~9.8
ということで中和滴定する際には10mLの時のpHジャンプで変色するような指示薬を使わなければならない。
よって
- 強酸+強塩基→中和点は中性なのでppもMOも可。
- 弱酸+強塩基→中和点は塩基性なのでppのみ使用可。
- 強酸+弱塩基→中和点は酸性なのでMOのみ使用可。
※弱酸+弱塩基はpHジャンプが小さく、指示薬での滴定は難しい。
ここで一息!中和滴定の計算を1問見てみる。
- Ex) 濃度未知のCH3COOH 10mLを中和するのに、10 mol/LのBa(OH)2を17.6mL要した。CH3COOHの濃度は?
(H+のmol)=(OH–のmol)より、
\(x\times\frac{10}{1000}\times1=0.10\times\frac{17.6}{1000}\times2\)
∴x=0.352mol/L と求められる。
中和滴定に用いる器具
最後に中和滴定に用いる器具についてみていく。
ビュレットとコニカルビーカーは先ほど見た通りである。
ここでビュレットは実は水洗いをしてはいけない。なぜならば、濃度を計算するための滴定において、滴下する道具であるビュレットに水滴が残っていると濃度が変わってしまい、大問題だからである。
そのため、ビュレットを洗う際には滴下する溶液で洗うという共洗いをしなければならない。
- ホールピペット…溶液の体積を正確に測り取る器具。正確性が鍵となり、これも共洗いにしなくてはならない。

図3 ホールピペット
- メスフラスコ…溶液を正確に希釈(薄めること)するための道具。水で希釈するため、水洗いで良い。

図4 メスフラスコ
塩の種類
CH3COOH+NaOH→CH3COONa+H2O…①
H2SO4+NaOH→NaHSO4+ H2O…②
H2SO4+2NaOH→Na2SO4+2 H2O…③
HCl+Mg(OH)2→MgCl(OH)+ H2O…④
ここに様々な中和反応を書いたが、塩は3種類に分けられる。
②と③を比べると分かりやすいが、②のように塩にHが残っているものを酸性塩、③のようにHもOHも塩に残っていないものを正塩、④のように塩にOHが残っているものを塩基性塩という。
①は正塩である。ただし、酸性塩だからといって酸性というわけでないので注意。
(その塩の溶性は、強酸・強塩基由来なら中性、弱酸・強塩基由来なら塩基性、強酸・弱塩基由来なら酸性が多いという⑹で見たような中和点の溶性で決まる。)