Contents
金属のイオン化傾向
イオン化傾向
固体の金属が水溶液中でどのくらい、e–を放出して陽イオンになりたいかという程度を示したものをイオン化傾向という。イオン化傾向は大きい順に、
イオン化傾向大⇦ ⇨イオン化傾向小
K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > (H2) > Cu > Hg > Ag > Pt > Au
貸そう か な まあ ある あ て に す な ひ ど す ぎる 借 金
(陽イオンになりやすい⇦ ⇨陽イオンになりにくい)
となっている。酸化されやすいと順と言うことも出来る。
- Ex) CuとZnではZnのほうがイオン化傾向が大きいので、Cu2+を含む溶液にZn板を溶かすと、e–の移動(酸化還元)が起こり、
Cu2+ + 2e– → Cu
Zn → Zn2+ + 2e–
となってCuが析出する。当然Zn2+を含む溶液にCu板を溶かす、という逆をやっても何も起こらない。 - Ex2) Mg + 2HCl → MgCl2 + H2 …①
Cu + 2HCl → CuCl2 + H2 …②
塩酸に金属を溶かす反応①、②の内、実際に起こるのは①のみである。
①はMg → Mg2+ + 2e– 、2H+ + 2e– → H2 というのが
イオン化傾向 Mg > (H2)合致するが、
②はCu → Cu2+ + 2e–、2H+ + 2e– → H2 が
イオン化傾向 (H2) > Cuと合致していないからである。
このように、酸化還元反応は起こりやすさを考える上でイオン化傾向はとても大切な概念である。
※Hは非金属だが比較の基準のために慣例的に入っている。
★発展 ※イオン化傾向とイオン化エネルギー
この2つはとてもよく似た概念である。
イオン化傾向とは「固体の」金属が「水溶液中で」どのくらいe–を取られてイオンになりやすいか、を示すのに対し、イオン化エネルギーは「原子1つ」が「気体状態で」どのくらいe–を取られてイオンになるためにエネルギーが必要か表している。
どちらも陽イオンへのなりやすさを表しているものの状態が異なり、イオン化傾向はイオン化エネルギーの他に昇華熱(気体から固体へのなりやすさ)や水和熱(水溶液とのなじみやすさ)も考慮されている。
高校化学の大半の反応は水溶液中で行われるため、イオン化傾向が頻繁に用いられることになる。
イオン化傾向と反応性
最後にイオン化傾向と、水や酸との反応性について見ておく。

図1
以上に示した通り、イオン化傾向の大きい金属は水と反応して水素を発生させる。
- Ex) 2Na + 2H2O → 2NaOH + H2
H2OのO原子からe–を引き抜かれて酸化される
また水素よりイオン化傾向が大きい金属は酸と反応して溶ける。 - Ex2) Zn + H2SO4 → ZnSO4 + H2 (Zn + 2H+ → Zn2+ + H2 ということ!)
イオン化傾向Zn > (H2)よりH+からe–を引き抜かれて酸化される
ただし、Fe、Ni、Al、Cr、Co(て、に、ある、くろ、こ)に関しては硝酸や熱濃硫酸といった、きわめて酸化力の強い酸に入れると、表面に緻密な酸化被膜を形成して内部を守る不動態を形成してしまう。
そして、イオン化傾向のきわめて低いPtとAuについては、硝酸や熱濃硫酸にすら溶けないが、硝酸と塩酸を1:3(一生三円)で混合した王水のみ溶ける。
ボルタ電池
酸化還元反応ではe–の移動によって反応がすすむ。このe–の移動を電流として取り出した装置を電池という。
歴史的に1番初めに考えられた電池が以下のボルタ電池である。

図2
イオン化傾向の大きなZnが、e–を放出してZn → Zn2+ + 2e– となり、このe–がCu板へ流れ込み、溶液中のH+がe–を受け取って2H+ + 2e– → H2 となる。
(金属であるCuが電子を受け取ることはない※ので溶液の中のイオンが電子を受け取る。)
このように2枚の金属板電解質溶液に浸してe–が流れるようにすることで電池として成り立っている。
※金属結合はいらないe–を押しつけあう結合なので。
電池においてe–を放出する電極を負極といい、e–を受け取る電極を正極という。ただし、e–の流れる向きと実際の電流の向きは逆になっており、(電流は+の流れとして捉えるので)正極から負極へ電流が流れている。
そのため、ボルタ電池においては
負極 Zn → Zn2+ + 2e–
正極 2H+ + 2e– → H2
という半反応式になっている。これを足すと全体の反応式
Zn + 2H+ → Zn2+ + H2 となる。
ただし、ボルタ電池においては1つ問題点がある。正極のCu板で発生するH2が泡としてCu板のまわりに付着していき、H+がe–を受け取りに近づきにくくなっていってしまう。その結果、起電力が下がっていってしまう。これを分極という。この問題点を解消したものが次に紹介するダニエル電池である。
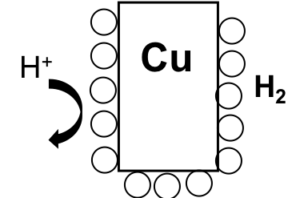
図3
ダニエル電池

図4
図4のように正極側のみCu2+入りの水溶液に代えることで、H+よりイオン化傾向の小さいCu2+がe–を受け取ってくれて分極問題が解決した。
負極 Zn → Zn2+ + 2e–
正極 Cu2+ +2e– → Cu
(全体 Zn + Cu2+ → Zn2+ + Cu)
ダニエル電池は充電が出来るというのも大きな特徴である。
充電は放電の逆なので、電気エネルギーに加えて、上式の逆向きに無理やり反応を進めることで可能である。(イオン化傾向に反する向きなので自然には起こらない。)
このように充電が出来る電池を二次電池という。一方で、ボルタ電池は充電が出来ない。
これは正極で発生したH2が空気中へ消えていってしまうため、逆向きの反応を起こせないからである。このように充電が出来ない電池を一次電池という。
鉛蓄電池
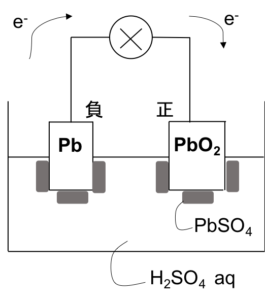
図5
安価で手に入るPbを極板としているため、よく使われる二次電池。重いので自動車のバッテリーなどに主に用いられる。
酸化数が0のPbと、酸化数4のPbO2を極板とし、どちらもが中間の酸化数2のPb2+を目指すことでe–の移動が起こる。
よって
負極 Pb → Pb2+ + 2e–
正極 PbO2 + 4H+ + 2e– → Pb2+ + 2H2O
となるが、ここでPb2+と溶液中のSO42-はとても相性が良くてPbSO4という沈殿を即座に作ることが知られており、(沈殿は詳しくは無機化学の章で扱う。)
正しくは以下の半反応式となる。
負極 Pb + SO42- → PbSO4 + 2e–
正極 PbO2 + 4H+ + SO42- + 2e– → PbSO4 + 2H2O
全体 Pb + PbSO4 + 2H2SO4 →(放電)
←(充電) 2PbSO4 + 2H2O
燃料電池
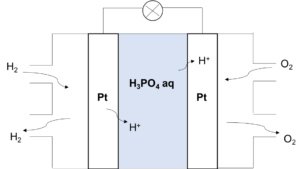
図6
水素の燃焼エネルギーを利用した電池。
生成するのがH2Oのみなのでクリーンで、しかも発電効率が高いため、こちらも自動車への応用が進んでいる。(充電の必要がなく、H2とO2さえ供給し続ければよいのが特徴。)
負極 H2 → 2H+ + 2e–
正極 O2 + 4H+ + 4e– → 2H2O
全体 2H2 + O2 → 2H2O
電気分解
電気分解とは
放っておくと自然と酸化還元反応が起こり、電流が流れた電池とは対象的に、進行しにくい酸化還元反応を外部から電流を流すことで無理やり進行させることを電気分解という。
- Ex) CuCl2aqの電気分解
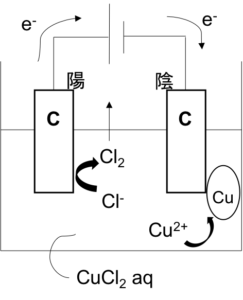
図7
電気分解において、電源の+極とつながっている極板を陽極(=負極に対応)、-極とつながっている極板を陰極(=正極に対応)という。
陽極 2Cl– → Cl2 + 2e–
陰極 Cu2+ + 2e– → Cu
このように陽極ではCl2が発生し、陰極ではCuが析出する。
電池とは異なり、電気分解においては何の溶液をどのような電極を用いて電気分解するかによって様々なバリエーションが考えられる。そこで、未知のものについても自力で半反応式が立てられるように、以下のステップをふまえて反応考えていく。
陽極での反応
陽極ではe–を出したいものが積極的に、酸化されていく。
- 極板がイオン化傾向Ag以上の金属なら極板自身が溶けてe–を出す。
- ①でない(PtやCなど)場合は溶液中の-イオンがe–を出す。
-イオン同士では I– > Br– > Cl– > OH– > NO3– > SO42-の順にe–を出しやすい。(覚え方としては原子の数が少ないほどe–を出しやすい、としておくとよい。) - 水のイオン積から分かるように水中ではH+とOH–はほぼ存在しないため、②でOH–が出てきた場合、それがH2O由来のものなら、H+を加えてOH–をH2Oに戻した形で表記する。
陰極での反応
陰極ではe–を受け取りたいものが積極的に還元されていく。
- 溶液中に存在する+イオンの内、イオン化傾向の低いものがe–を受け取る。
(陽極と異なり、還元なので極板チェックはいらない!) - 陽極③と同様に①でH+が出てきた場合、それがH2O由来のものなら、OH–を加えてH2Oに戻した形で表記する。
例題
これはとにかく練習あるのみ!
- CuCl2aqの電気分解(陽極:Pt、陰極:Pt)
- CuSO4aqの電気分解(陽極:Cu、陰極:Cu)
- CuSO4aqの電気分解(陽極:Pt、陰極:Pt)
- H2Oの電気分解(陽性: Pt、陰性:Pt)
- NaOHaqの電気分解(陽極:Pt、陰極:Pt)
- H2SO4aqの電気分解(陽極:Pt、陰極:Pt)
- AgNO3aqの電気分解(陽極:Ag、陰極:Pt)
- NaClaqの電気分解(陽極:Pt、陰極:Pt)
【解答】
- 溶液中に存在するイオンはCu2+、H+、Cl–、OH–の4つ。
陽極では、まずPtが①にあてはまらず、②よりCl–とOH–を比べた時にCl–の方が酸化されやすい。そのため今回は③は考えなくて良い。
陽極 : 2Cl– → Cl2 + 2e–
陰極では、①よりCu2+とH+ではCu2+の方が還元されやすい。そのため②は考えなくてよい。
陰極 : Cu2+ + 2e– → Cu - 溶液中に存在するイオンはCu2+、H+、SO42-、OH–の4つ
陽極では、まず①よりCu極板自身が溶ける。よって②以降は考えなくてよい。
陽極 : Cu → Cu2+ + 2e–
陰極では、まず①よりCu2+とH+ではCu2+の方が還元されやすい。そのため、②は考えなくてよい。
陰極 : Cu2+ + 2e– → Cu - 溶液中に存在するイオンはCu2+、H+、SO42-、OH–の4つ。
陽極ではまずPtが①にあてはまらず、②よりSO42-とOH–を比べた時にOH–の方が酸化されやすい。
4OH– → O2 + 2H2O + 4e–
しかし、③よりOH–はH2O由来なので両辺に4H+を加えて戻してあげる。
陽極 : 2H2O → O2 + 4H+ + 4e–
陰極では ②の時と全く同じ
陰性 : Cu2+ + 2e– → Cu - 溶液中に存在するイオンはH+、OH–の2つ。
陽極では、まずPtが①にあてはまらず、②よりOH–が酸化される。
4OH– → O2 + 2H2O + 4e–
しかし、このOH–はH2O由来なので両辺に4H+を加えて戻してあげる。
陽極 : 2H2O → O2 + 4H+ + 4e–
陰極では、①よりH+が還元される。
2H+ + 2e– → H2
しかし、このH+がH2O由来なので②より両辺に2OH–を加えて戻してあげる。
陰極 : 2H2O + 2e– → H2 + 2OH– - 溶液中に存在するイオンはH+、Na+、OH–の3つ。
陽極では、まずPtが①にあてはまらず、②よりOH–が酸化される。
OH–はNaOH由来と考えてよいので、③でH2Oに戻す必要はない。
陽極 : 4OH– → O2 + 2H2O + 4e–
陰極では、①よりH+、Na+ではH+のほうが還元される。これはH2O由来なので②より戻してあげて、
陰極 : 2H2O + 2e– → H2 + 2OH– - 陽極 : 2H2O → O2 + 4H+ + 4e–
陰極 : 2H+ + 2e– → H2 - 陽極 : Ag → Ag+ + e–
陰極 : Ag+ + e– → Ag - 陽極 : 2Cl– → Cl2 + 2e–
陰極 : 2H2O + 2e– → H2 + 2OH–
電気分解と量的関係
物理分野の話になるが、電流[A](アンペア)は1秒あたりにある面積を通過する電気量[c](クーロン)と定義されている。そのため、
電気量[c] = 電流[A] × 時間[s]
が成り立つ。ここで、電気量とは + や – の電荷の総量と考えておけば十分である。
例えば2Aの電流を1分間流したとすると、流れた総電気量は
2 × 60 = 120 c である。
また、e–1つが持つ電気量は1.6×10-19cである。よって1molあたりに換算すると、
e–1molが持つ電気量は1.6×10-19×6.02×1023≒9.65×104 c/mol と求まる。
この値は化学ではよく使うのでファラデー定数とよばれている。
電流とはe–の流れが正体であったことから、上の2つを組み合わせ、
電流[A] × 流れた時間[s] = 流れたe–のmol × ファラデー定数
という関係式を導くことができる。これは実質的にファラデーの法則と呼ばれており、左辺も右辺も回路に流れた総電気量を表している。
- Ex) CuSO4aqをPt電極を用いて、400Aで16分5秒通電することにより電気分解した。この時、陽極で発生する気体は標準状態で何mL?
まず陽極での半反応式は 2H2O → O2 + 4H+ + 4e–
なのでO2が発生する。
次に、ファラデーの法則より
0.400[A] × 965[s] = (e–のmol) × 9.65×104
∴(e–のmol) = 4.00×10-3 mol
ここで半反応式の係数を見ることで、e–の1/4倍のmolがO2なので
(O2のmol) = 1.00×10-3 mol
したがって、22.4L × 1000mL × 1.00×10-3 = 22.4mL となる。
おすすめ記事
参考